
Physikalische und chemische Eigenschaften von Alkenen. Allgemeine Formel von Alkenen. Eigenschaften und Eigenschaften von Alkenen
Alkene sind chemisch aktiv. Ihre Chemische Eigenschaften werden weitgehend durch das Vorhandensein einer Doppelbindung bestimmt. Die häufigsten Reaktionen für Alkene sind elektrophile Additionen und radikalische Additionsreaktionen. Nukleophile Additionsreaktionen erfordern normalerweise die Anwesenheit eines starken Nukleophils und sind für Alkene nicht typisch. Alkene gehen leicht Oxidations- und Additionsreaktionen ein und sind auch zur Substitution durch Arylradikale fähig.
Additionsreaktionen
Hydrierung Die Addition von Wasserstoff (Hydrierungsreaktion) an Alkene erfolgt in Gegenwart von Katalysatoren. Am häufigsten werden zerkleinerte Metalle verwendet – Platin, Nickel, Palladium usw. Dadurch entstehen die entsprechenden Alkane (gesättigte Kohlenwasserstoffe).
$CH_2=CH_2 + H2 → CH_3–CH_3$
Zusatz von Halogenen. Alkene reagieren unter normalen Bedingungen leicht mit Chlor und Brom und bilden die entsprechenden Dihalogenalkane, in denen sich Halogenatome an benachbarten Kohlenstoffatomen befinden.
Anmerkung 1
Wenn Alkene mit Brom interagieren, verfärbt sich Brom gelbbraun. Dies ist eines der ältesten und einfachsten qualitative Reaktionen zu ungesättigten Kohlenwasserstoffen, da auch Alkine und Alkadiene ähnlich reagieren.
$CH_2=CH_2 + Br_2 → CH_2Br–CH_2Br$
Zugabe von Halogenwasserstoffen. Wenn Ethylenkohlenwasserstoffe mit Halogenwasserstoffen ($HCl$, $HBr$) interagieren, entstehen Halogenalkane; die Richtung der Reaktion hängt von der Struktur der Alkene ab.
Bei Ethylen oder symmetrischen Alkenen verläuft die Additionsreaktion eindeutig und führt zur Bildung nur eines Produkts:
$CH_2=CH_2 + HBr → CH_3–CH_2Br$
Bei unsymmetrischen Alkenen ist die Bildung zweier unterschiedlicher Additionsprodukte möglich:
Anmerkung 2
Tatsächlich entsteht hauptsächlich nur ein Reaktionsprodukt. Das Muster in der Richtung solcher Reaktionen wurde vom russischen Chemiker V.V. Markownikow im Jahr 1869 Es wird Markownikows Herrschaft genannt. Bei der Wechselwirkung von Halogenwasserstoffen mit unsymmetrischen Alkenen wird an der Stelle der Spaltung der Doppelbindung im am stärksten hydrierten Kohlenstoffatom, also vor der Bindung, ein Wasserstoffatom angefügt Große anzahl Wasserstoffatome.
Markownikow formulierte diese Regel auf der Grundlage experimenteller Daten und erhielt erst viel später eine theoretische Begründung. Betrachten Sie die Reaktion von Propylen mit Chlorwasserstoff.
Eines der Merkmale der $p$-Anleihe ist ihre Fähigkeit, leicht polarisiert zu werden. Unter dem Einfluss der Methylgruppe (positiver induktiver Effekt + $I$) im Propenmolekül verschiebt sich die Elektronendichte der $p$-Bindung zu einem der Kohlenstoffatome (= $CH_2$). Dadurch entsteht darauf eine teilweise negative Ladung ($\delta -$). Am anderen Kohlenstoffatom der Doppelbindung erscheint eine teilweise positive Ladung ($\delta +$).
Diese Verteilung der Elektronendichte im Propylenmolekül bestimmt den Ort des zukünftigen Protonenangriffs. Dies ist das Kohlenstoffatom der Methylengruppe (= $CH_2$), das eine teilweise negative Ladung $\delta-$ trägt. Und Chlor greift dementsprechend ein Kohlenstoffatom mit einer teilweise positiven Ladung $\delta+$ an.
Infolgedessen ist das Hauptprodukt der Reaktion von Propylen mit Chlorwasserstoff 2-Chlorpropan.
Flüssigkeitszufuhr
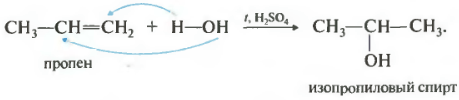
Die Hydratation von Alkenen erfolgt in Gegenwart von Mineralsäuren und gehorcht der Markownikow-Regel. Die Reaktionsprodukte sind Alkohole
$CH_2=CH_2 + H_2O → CH_3–CH_2–OH$
Alkylierung
Addition von Alkanen an Alkene in Gegenwart eines sauren Katalysators ($HF$ oder $H_2SO_4$) bei niedrige Temperaturen führt zur Bildung von Kohlenwasserstoffen mit höherem Molekulargewicht und wird in der Industrie häufig zur Herstellung von Kraftstoffen verwendet
$R–CH_2=CH_2 + R’–H → R–CH_2–CH_2–R’$
Oxidationsreaktionen
Die Oxidation von Alkenen kann je nach Bedingungen und Art der Oxidationsreagenzien sowohl unter Spaltung der Doppelbindung als auch unter Erhalt des Kohlenstoffgerüsts erfolgen:
Polymerisationsreaktionen
Alkenmoleküle sind unter bestimmten Bedingungen in der Lage, sich unter der Öffnung von $\pi$-Bindungen und der Bildung von Dimeren, Trimeren oder hochmolekularen Verbindungen – Polymeren – zu addieren. Die Polymerisation von Alkenen kann entweder über einen freien Radikal- oder einen Kation-Anion-Mechanismus erfolgen. Als Polymerisationsinitiatoren werden Säuren, Peroxide, Metalle usw. verwendet. Die Polymerisationsreaktion erfolgt ebenfalls unter Einfluss von Temperatur, Strahlung und Druck. Ein typisches Beispiel ist die Polymerisation von Ethylen zu Polyethylen
$nCH_2=CH_2 → (–CH_2–CH_(2^–))_n$
Substitutionsreaktionen
Substitutionsreaktionen sind für Alkene nicht typisch. Wann jedoch hohe Temperaturen(über 400 °C) radikalische Additionsreaktionen, die reversibel sind und unterdrückt werden. In diesem Fall wird es möglich, das in Allylstellung befindliche Wasserstoffatom unter Beibehaltung der Doppelbindung zu ersetzen
$CH_2=CH–CH_3 + Cl_2 – CH_2=CH–CH_2Cl + HCl$
Alkene zeichnen sich vor allem durch Reaktionen aus Beitritt durch eine Doppelbindung. Grundsätzlich laufen diese Reaktionen nach einem ionischen Mechanismus ab. Die Pi-Bindung wird aufgebrochen und es entstehen zwei neue Sigma-Bindungen. Ich möchte Sie daran erinnern, dass Substitutionsreaktionen typisch für Alkane waren und einem radikalen Mechanismus folgten. Wasserstoffmoleküle können sich an Alkene anlagern; diese Reaktionen werden Hydrierung, Wassermoleküle, Hydratation, Halogenierung, Hydrohalogenierung von Halogenwasserstoffen genannt. Aber das Wichtigste zuerst.
Additionsreaktionen von Doppelbindungen
Also, Erste chemische Eigenschaft Fähigkeit zur Zugabe von Halogenwasserstoffen, Hydrohalogenierung.
Propen und andere Alkene reagieren mit Halogenwasserstoffen gemäß der Markownikow-Regel.

Ein Wasserstoffatom bindet an das am stärksten hydrierte oder genauer gesagt hydrierte Kohlenstoffatom.
Zweite Die Nummer auf unserer Eigenschaftsliste wäre Hydratation, die Zugabe von Wasser.
Die Reaktion erfolgt beim Erhitzen in Gegenwart einer Säure, üblicherweise Schwefel- oder Phosphorsäure. Auch die Anlagerung von Wasser erfolgt nach der Markownikow-Regel, d. h. primärer Alkohol kann nur durch Hydratisierung von Ethylen gewonnen werden, die restlichen unverzweigten Alkene ergeben sekundäre Alkohole.
Es gibt Ausnahmen von Markownikows Regel sowohl für die Hydrohalogenierung als auch für die Hydratation. Erstens erfolgt die Zugabe entgegen dieser Regel in Gegenwart von Peroxiden.
Zweitens für Derivate von Alkenen, in denen elektronenziehende Gruppen vorhanden sind. Zum Beispiel für 3,3,3-Trifluorpropen-1.

Aufgrund ihrer hohen Elektronegativität ziehen Fluoratome entlang einer Kette von Sigma-Bindungen Elektronendichte an sich. Dieses Phänomen wird als negativer induktiver Effekt bezeichnet.

Dadurch werden die beweglichen Pi-Elektronen der Doppelbindung verdrängt und das äußerste Kohlenstoffatom erhält eine teilweise positive Ladung, die üblicherweise als Delta-Plus bezeichnet wird. Dorthin wandert das negativ geladene Bromion und das Wasserstoffkation bindet sich an das am wenigsten hydrierte Kohlenstoffatom.
Neben der Trifluormethylgruppe haben beispielsweise die Trichlormethylgruppe, Nitrogruppe, Carboxylgruppe und einige andere eine negativ induktive Wirkung.
Dieser zweite Fall eines Verstoßes gegen die Markownikow-Regel im Einheitlichen Staatsexamen kommt sehr selten vor, es ist jedoch dennoch ratsam, ihn im Hinterkopf zu behalten, wenn Sie planen, die Prüfung mit der Höchstpunktzahl zu bestehen.
Dritte chemische Eigenschaft Bindung von Halogenmolekülen.

Dies betrifft vor allem Brom, da diese Reaktion qualitativ für eine Mehrfachbindung ist. Wenn beispielsweise Ethylen durch Bromwasser, also eine Lösung von Brom in Wasser mit brauner Farbe, geleitet wird, verfärbt es sich. Wenn Sie eine Gasmischung, beispielsweise Ethan und Ethen, durch Bromwasser leiten, erhalten Sie reines Ethan ohne Ethenverunreinigungen, da es in Form von Dibromethan, einer Flüssigkeit, im Reaktionskolben verbleibt.
Besonders hervorzuheben ist die Reaktion von Alkenen in der Gasphase unter starker Erwärmung, beispielsweise mit Chlor.
Unter solchen Bedingungen kommt es nicht zu einer Additionsreaktion, sondern zu einer Substitutionsreaktion. Darüber hinaus ausschließlich am Alpha-Kohlenstoffatom, also dem Atom, das der Doppelbindung benachbart ist. In diesem Fall wird 3-Chlorpropen-1 erhalten. Diese Reaktionen kommen in der Prüfung selten vor, sodass sich die meisten Studierenden nicht daran erinnern und in der Regel Fehler machen.
Vierte Zahl ist die Hydrierungsreaktion und damit die Dehydrierungsreaktion. Das heißt, die Zugabe oder Entfernung von Wasserstoff.

Die Hydrierung erfolgt bei nicht sehr hoher Temperatur an einem Nickelkatalysator. Bei höheren Temperaturen ist eine Dehydrierung zur Bildung von Alkinen möglich.
Fünfte Eine Eigenschaft von Alkenen ist die Fähigkeit zur Polymerisation, wenn Hunderte und Tausende von Alkenmolekülen durch das Aufbrechen der Pi-Bindung und die Bildung von Sigma-Bindungen untereinander sehr lange und starke Ketten bilden.
In diesem Fall war das Ergebnis Polyethylen. Bitte beachten Sie, dass das resultierende Molekül keine Mehrfachbindungen enthält. Solche Stoffe nennt man Polymere, die ursprünglichen Moleküle nennt man Monomere, das wiederkehrende Fragment ist die Elementareinheit des Polymers und die Zahl n ist der Polymerisationsgrad.
Auch Reaktionen zur Herstellung anderer wichtiger Polymermaterialien wie Polypropylen sind möglich.


Ein weiteres wichtiges Polymer ist Polyvinylchlorid.

Ausgangsstoff für die Herstellung dieses Polymers ist Chlorethen, dessen gebräuchlicher Name Vinylchlorid ist. Denn dieser ungesättigte Substituent heißt Vinyl. Eine gebräuchliche Abkürzung für Plastik PVC-Produkte steht einfach für Polyvinylchlorid.
Wir haben fünf Eigenschaften besprochen, die Ddarstellen. Schauen wir uns nun die Reaktionen an Oxidation.
Alkenoxidationsreaktionen
Sechste Die chemische Eigenschaft in unserer allgemeinen Liste ist leichte Oxidation oder Wagner-Reaktion. Sie entsteht, wenn ein Alken in der Kälte einer wässrigen Lösung von Kaliumpermanganat ausgesetzt wird, weshalb bei Prüfungsaufgaben oft die Temperatur von null Grad angegeben wird.
Das Ergebnis ist zweiwertiger Alkohol. In diesem Fall handelt es sich um Ethylenglykol, im Allgemeinen handelt es sich jedoch um Alkohole gemeinsamen Namen Glykole Während der Reaktion verfärbt sich die violett-rosa Permanganatlösung, daher ist diese Reaktion auch für eine Doppelbindung qualitativ. Mangan wird in einer neutralen Umgebung von der Oxidationsstufe +7 auf die Oxidationsstufe +4 reduziert. Schauen wir uns noch ein paar Beispiele an. DIE GLEICHUNG
Hier erhalten wir Propandiol-1,2. Allerdings reagieren zyklische Alkene auf die gleiche Weise. DIE GLEICHUNG
Eine andere Möglichkeit besteht darin, dass sich die Doppelbindung beispielsweise in der Seitenkette aromatischer Kohlenwasserstoffe befindet. Regelmäßig in Prüfungsaufgaben Es gibt eine Wagner-Reaktion mit Styrol, ihr zweiter Name ist Vinylbenzol.

Ich hoffe, dass ich genügend Beispiele angeführt habe, damit Sie verstehen, dass die milde Oxidation einer Doppelbindung immer einer ziemlich einfachen Regel folgt: Die Pi-Bindung wird aufgebrochen und an jedes Kohlenstoffatom wird eine Hydroxygruppe hinzugefügt.
Nun zur harten Oxidation. Es wird uns gehören siebte Eigentum. Diese Oxidation tritt auf, wenn ein Alken beim Erhitzen mit einer sauren Lösung von Kaliumpermanganat reagiert.
Es kommt zur Zerstörung des Moleküls, also zu seiner Zerstörung an der Doppelbindung. Im Fall von Buten-2 wurden zwei Moleküle Essigsäure erhalten. Im Allgemeinen kann anhand der Oxidationsprodukte auf die Position der Mehrfachbindung in der Kohlenstoffkette geschlossen werden.
Bei der Oxidation von Buten-1 entsteht ein Molekül aus Propionsäure (Propansäure) und Kohlendioxid.
Im Fall von Ethylen entstehen zwei Moleküle Kohlendioxid. In allen Fällen wird Mangan in einer sauren Umgebung von der Oxidationsstufe +7 auf +2 reduziert.
Und endlich, achte Eigenschaft vollständige Oxidation oder Verbrennung.
Alkene verbrennen wie andere Kohlenwasserstoffe zu Kohlendioxid und Wasser. Schreiben wir die Gleichung für die Verbrennung von Alkenen auf Gesamtansicht.
Es gibt so viele Kohlendioxidmoleküle wie Kohlenstoffatome im Alkenmolekül, da das CO 2 -Molekül ein Kohlenstoffatom enthält. Das heißt, n CO 2 -Moleküle. Es wird doppelt so viele Wassermoleküle wie Wasserstoffatome geben, also 2n/2, also nur n.
Links und rechts sind gleich viele Sauerstoffatome vorhanden. Auf der rechten Seite sind 2n Kohlendioxid plus n Wasser, also insgesamt 3n. Auf der linken Seite gibt es die gleiche Anzahl an Sauerstoffatomen, was bedeutet, dass es doppelt so viele Moleküle gibt, da das Molekül zwei Atome enthält. Das sind 3n/2 Sauerstoffmoleküle. Sie können 1,5n schreiben.
Wir haben überprüft acht chemische Eigenschaften von Alkenen.
4. Chemische Eigenschaften von Alkenen
Die Energie einer Kohlenstoff-Kohlenstoff-Doppelbindung in Ethylen (146 kcal/mol) ist deutlich niedriger als die doppelte Energie einer einfachen C-C-Bindung in Ethan (2 88 = 176 kcal/mol). Die -C-Bindung in Ethylen ist stärker als die -Bindung, daher sind Reaktionen von Alkenen, die mit der Spaltung der -Bindung unter Bildung zweier neuer einfacher -Bindungen einhergehen, ein thermodynamisch günstiger Prozess. Beispielsweise sind in der Gasphase nach berechneten Daten alle unten aufgeführten Reaktionen exotherm mit einer deutlich negativen Enthalpie, unabhängig von ihrem tatsächlichen Mechanismus.
Aus Sicht der Theorie der Molekülorbitale lässt sich auch schlussfolgern, dass die -Bindung reaktiver ist als die -Bindung. Betrachten wir die Molekülorbitale von Ethylen (Abb. 2).

Tatsächlich hat das bindende Orbital von Ethylen eine höhere Energie als das bindende Orbital, und umgekehrt liegt das antibindende *-Orbital von Ethylen unterhalb des antibindenden *-Orbitals der C=C-Bindung. Unter normalen Bedingungen sind die *- und *-Orbitale von Ethylen unbesetzt. Folglich sind die Grenzorbitale von Ethylen und anderen Alkenen, die ihre Reaktivität bestimmen, -Orbitale.
4.1. Katalytische Hydrierung von Alkenen
Obwohl die Hydrierung von Ethylen und anderen Alkenen zu Alkanen mit der Freisetzung von Wärme einhergeht, läuft diese Reaktion nur in Gegenwart bestimmter Katalysatoren mit merklicher Geschwindigkeit ab. Der Katalysator hat per Definition keinen Einfluss auf den thermischen Effekt der Reaktion und seine Rolle beschränkt sich auf die Reduzierung der Aktivierungsenergie. Es muss zwischen heterogener und homogener katalytischer Hydrierung von Alkenen unterschieden werden. Bei der heterogenen Hydrierung werden fein gemahlene Metallkatalysatoren verwendet – Platin, Palladium, Ruthenium, Rhodium, Osmium und Nickel, entweder in reiner Form oder auf inerten Trägern – BaSO 4, CaCO 3, Aktivkohle, Al 2 O 3 usw. Alle von ihnen sind in organischen Medien unlöslich und wirken als heterogene Katalysatoren. Am aktivsten sind Ruthenium und Rhodium, am weitesten verbreitet sind jedoch Platin und Nickel. Platin wird üblicherweise in Form von Schwarzdioxid PtO 2 verwendet, das allgemein als Adams-Katalysator bekannt ist. Platindioxid wird durch Schmelzen von Chlorplatinsäure H 2 PtCl 6 gewonnen. 6H 2 O oder Ammoniumhexachloroplatinat (NH 4) 2 PtCl 6 mit Natriumnitrat. Die Hydrierung von Alkenen mit einem Adams-Katalysator erfolgt üblicherweise bei Normaldruck und einer Temperatur von 20–50 0 C in Alkohol, Essigsäure, Ethylacetat. Beim Durchleiten von Wasserstoff wird Platindioxid direkt im Reaktionsgefäß zu Platinschwarz reduziert, das die Hydrierung katalysiert. Andere aktivere Metalle der Platingruppe werden auf inerten Trägern verwendet, beispielsweise Pd/C oder Pd/BaSO 4, Ru/Al 2 O 3; Rh/C usw. Auf Kohle geträgertes Palladium katalysiert die Hydrierung von Alkenen zu Alkanen in einer Alkohollösung bei 0–20 °C und Normaldruck. Nickel wird üblicherweise in Form des sogenannten „Raney-Nickels“ verwendet. Um diesen Katalysator zu erhalten, wird eine Nickel-Aluminium-Legierung mit heißem wässrigem Alkali behandelt, um fast das gesamte Aluminium zu entfernen, und dann mit Wasser, bis eine neutrale Reaktion erfolgt. Der Katalysator hat eine poröse Struktur und wird daher auch als Skelett-Nickel-Katalysator bezeichnet. Typische Bedingungen für die Hydrierung von Alkenen über Raney-Nickel erfordern die Verwendung eines Drucks in der Größenordnung von 5–10 atm und einer Temperatur von 50–100 °C, d. h. dieser Katalysator ist viel weniger aktiv als Metalle der Platingruppe, aber er ist billiger . Nachfolgend finden Sie einige typische Beispiele für die heterogene katalytische Hydrierung von acyclischen und cyclischen Alkenen:


Da beide Wasserstoffatome von der Oberfläche des Katalysatormetalls an die Kohlenstoffatome der Doppelbindung addiert werden, erfolgt die Addition üblicherweise auf einer Seite der Doppelbindung. Diese Art der Verbindung wird aufgerufen syn- Beitritt. In Fällen, in denen zwei Reagenzfragmente an verschiedenen Seiten einer Mehrfachbindung (Doppel- oder Dreifachbindung) angefügt werden, Anti- Beitritt. Bedingungen syn- Und Anti- haben die gleiche Bedeutung wie die Begriffe cis- Und Trance-. Um Verwirrung und Missverständnisse der Begriffe zu vermeiden syn- Und Anti- beziehen Sie sich auf die Art der Verbindung und die Bedingungen cis- Und Trance- zur Struktur des Untergrundes.
Die Doppelbindung in Alkenen wird im Vergleich zu vielen anderen funktionellen Gruppen (C=O, COOR, CN usw.) schneller hydriert und daher ist die Hydrierung der C=C-Doppelbindung oft ein selektiver Prozess, wenn die Hydrierung durchgeführt wird In milde Bedingungen(0-20 0 C und bei Luftdruck). Nachfolgend einige typische Beispiele:


Der Benzolring wird unter diesen Bedingungen nicht reduziert.
Eine große und grundlegend wichtige Errungenschaft in der katalytischen Hydrierung ist die Entdeckung löslicher Metallkomplexe, die die Hydrierung in einer homogenen Lösung katalysieren. Die heterogene Hydrierung an der Oberfläche von Metallkatalysatoren hat eine Reihe erheblicher Nachteile, wie z. B. die Isomerisierung von Alkenen und die Spaltung einzelner Kohlenstoff-Kohlenstoff-Bindungen (Hydrogenolyse). Die Homogenhydrierung weist diese Nachteile nicht auf. Hinter letzten Jahren Es wurde eine große Gruppe homogener Hydrierungskatalysatoren – Übergangsmetallkomplexe mit verschiedenen Liganden – erhalten. Die besten Katalysatoren für die homogene Hydrierung sind Komplexe von Rhodium(I)- und Ruthenium(III)-chloriden mit Triphenylphosphin – Tris(triphenylphosphin)rhodiumchlorid (Ph 3 P) 3 RhCl (Wilkinson-Katalysator) und Tris(triphenylphosphin)rutheniumhydrochlorid (Ph 3 P). ) 3 RuHCl. Der am besten zugängliche Rhodiumkomplex wird durch Reaktion von Rhodium(III)-chlorid mit Triphenylphosphin erhalten. Der Rhodiumkomplex von Wilkinson wird zur Hydrierung der Doppelbindung unter normalen Bedingungen verwendet.

Ein wichtiger Vorteil homogener Katalysatoren ist die Fähigkeit, aufgrund der großen Unterschiede in ihren Hydrierungsgeschwindigkeiten eine mono- oder disubstituierte Doppelbindung in Gegenwart einer tri- und tetrasubstituierten Doppelbindung selektiv zu reduzieren.

Bei homogenen Katalysatoren erfolgt auch die Wasserstoffanlagerung syn- Beitritt. Also Erholung cis-Buten-2 mit Deuterium führt unter diesen Bedingungen zu meso-2,3-Dideuterobutan.

4.2. Reduktion einer Doppelbindung mit Diimid
Die Reduktion von Alkenen zu den entsprechenden Alkanen kann mit Diimid NH=NH erfolgreich durchgeführt werden.
Diimid wird durch zwei Hauptmethoden gewonnen: die Oxidation von Hydrazin mit Wasserstoffperoxid in Gegenwart von Cu 2+ -Ionen oder die Reaktion von Hydrazin mit Ni-Raney (Hydrazin-Dehydrierung). Befindet sich im Reaktionsgemisch ein Alken, wird dessen Doppelbindung durch das sehr instabile Diimid hydriert. Eine Besonderheit dieser Methode ist die Strenge syn-Stereospezifität des Wiederherstellungsprozesses. Es wird angenommen, dass diese Reaktion über einen zyklisch aktivierten Komplex mit einer strikten Ausrichtung beider reagierender Moleküle im Raum abläuft.

4.3. Elektrophile Additionsreaktionen an der Doppelbindung von Alkenen
Die Grenz-HOMO- und LUMO-Orbitale von Alkenen sind die besetzten und leeren *-Orbitale. Folglich nimmt das -Orbital an Reaktionen mit Elektrophilen (E +) und das *-Orbital der C=C-Bindung an Reaktionen mit Nukleophilen (Nu -) teil (siehe Abb. 3). In den meisten Fällen reagieren einfache Alkene leicht mit Elektrophilen, reagieren jedoch nur sehr schwer mit Nukleophilen. Dies erklärt sich aus der Tatsache, dass das LUMO der meisten Elektrophile in der Regel energetisch nahe an der Energie des -HOMOs von Alkenen liegt, während das HOMO der meisten Nucleophile deutlich unter dem *-LUMO liegt.

Einfache Alkene reagieren nur mit sehr starken nukleophilen Mitteln (Carbanionen) unter rauen Bedingungen. Die Einführung elektronenziehender Gruppen in Alkene, beispielsweise NO 2, COR usw., führt jedoch aufgrund von zu einer Abnahme des *-Niveaus wodurch das Alken die Fähigkeit erlangt, mit Nukleophilen mittlerer Stärke (Ammoniak, RO) zu reagieren - , Nє C - , Enolat-Anion usw.).
Durch die Wechselwirkung des elektrophilen Mittels E + mit einem Alken entsteht ein Carbokation, das hochreaktiv ist. Das Carbokation wird durch die schnelle Zugabe des nukleophilen Wirkstoffs Nu weiter stabilisiert - :


Da es sich bei der langsamen Stufe um die Addition eines Elektrophils handelt, sollte der Prozess der Addition eines beliebigen polaren Mittels E + Nu – genau als elektrophile Addition an die Mehrfachbindung eines Alkens betrachtet werden. Es sind zahlreiche Reaktionen dieser Art bekannt, bei denen Halogene, Halogenwasserstoffe, Wasser, zweiwertige Quecksilbersalze und andere polare Reagenzien die Rolle des elektrophilen Mittels spielen. Die elektrophile Addition an eine Doppelbindung in der Klassifizierung organischer Reaktionsmechanismen hat das Symbol Ad E ( Addition elektrophil) und wird je nach Anzahl der reagierenden Moleküle als Ad E 2 (bimolekulare Reaktion) oder Ad E 3 (trimolekulare Reaktion) bezeichnet.
4.3.a. Halogenzusatz
Alkene reagieren mit Brom und Chlor zu Additionsprodukten an die Doppelbindung eines Halogenmoleküls mit nahezu quantitativer Ausbeute. Fluor ist zu aktiv und führt zur Zerstörung von Alkenen. Die Addition von Jod an Alkene ist in den meisten Fällen eine reversible Reaktion, deren Gleichgewicht sich in Richtung der ursprünglichen Reagenzien verschiebt.



Die schnelle Entfärbung einer Bromlösung in CCl4 dient als einer der einfachsten Tests für Ungesättigtheit, da Alkene, Alkine und Diene schnell mit Brom reagieren.
Die Addition von Brom und Chlor an Alkene erfolgt eher über einen ionischen als über einen radikalischen Mechanismus. Diese Schlussfolgerung ergibt sich aus der Tatsache, dass die Geschwindigkeit der Halogenzugabe nicht von der Bestrahlung, der Anwesenheit von Sauerstoff und anderen Reagenzien abhängt, die radikalische Prozesse initiieren oder hemmen. Basierend auf einer großen Anzahl experimenteller Daten wurde ein Mechanismus für diese Reaktion vorgeschlagen, der mehrere aufeinanderfolgende Stufen umfasst. In der ersten Stufe erfolgt die Polarisation des Halogenmoleküls unter Einwirkung bindender Elektronen. Das Halogenatom, das einen bestimmten Anteil positiver Ladung erhält, bildet mit den Elektronen der -Bindung ein instabiles Zwischenprodukt, das als -Komplex oder Ladungstransferkomplex bezeichnet wird. Es ist zu beachten, dass das Halogen im -Komplex keine gerichtete Bindung mit einem bestimmten Kohlenstoffatom eingeht; In diesem Komplex wird einfach die Donor-Akzeptor-Wechselwirkung einer Elektronenpaarbindung als Donor und eines Halogens als Akzeptor realisiert.

Anschließend wandelt sich der -Komplex in ein zyklisches Bromoniumion um. Bei der Bildung dieses zyklischen Kations kommt es zur heterolytischen Spaltung der Br-Br-Bindung und zur Bildung einer Leerstelle R-das sp 2-Orbital des hybridisierten Kohlenstoffatoms überlappt mit R-Orbital des „einsamen Elektronenpaars“ des Halogenatoms, das ein zyklisches Bromoniumion bildet.

Im letzten, dritten Stadium greift das Bromanion als nukleophiler Wirkstoff eines der Kohlenstoffatome des Bromoniumions an. Der nukleophile Angriff des Bromidions führt zur Öffnung des Dreirings und zur Bildung eines vicinalen Dibromids ( vic-nahe). Dieser Schritt kann formal als eine nukleophile Substitution von SN 2 am Kohlenstoffatom betrachtet werden, wobei die Abgangsgruppe Br+ ist.

Die Addition von Halogenen an die Doppelbindung von Alkenen gehört zu den formal einfachen Modellreaktionen, an deren Beispiel man den Einfluss der Hauptfaktoren betrachten kann, die begründete Rückschlüsse auf den detaillierten Mechanismus des Prozesses zulassen. Um fundierte Schlussfolgerungen über den Mechanismus einer Reaktion ziehen zu können, benötigen Sie Daten zu: 1) Reaktionskinetik; 2) Stereochemie (stereochemisches Ergebnis der Reaktion); 3) das Vorhandensein oder Fehlen eines damit verbundenen, konkurrierenden Prozesses; 4) der Einfluss von Substituenten im ursprünglichen Substrat auf die Reaktionsgeschwindigkeit; 5) Verwendung markierter Substrate und (oder) Reagenzien; 6) die Möglichkeit von Umlagerungen während der Reaktion; 7) die Wirkung des Lösungsmittels auf die Reaktionsgeschwindigkeit.
Betrachten wir diese Faktoren am Beispiel der Halogenierung von Alkenen. Kinetische Daten ermöglichen es, die Reihenfolge der Reaktion für jede Komponente festzulegen und daraus Rückschlüsse auf die Gesamtmolekularität der Reaktion, also die Anzahl der reagierenden Moleküle, zu ziehen.
Bei der Bromierung von Alkenen wird die Reaktionsgeschwindigkeit typischerweise durch die folgende Gleichung beschrieben:
v = k``[Alken] + k``[Alken] 2,
was in seltenen Fällen vereinfacht wird
v = k`[Alken].
Anhand der kinetischen Daten lässt sich schließen, dass ein oder zwei Brommoleküle am geschwindigkeitsbestimmenden Schritt beteiligt sind. Die zweite Ordnung im Brom bedeutet, dass nicht das Bromidion Br - mit dem Bromoniumion reagiert, sondern das Tribromidion, das durch die Wechselwirkung von Brom und Bromidion entsteht:
![]()
Dieses Gleichgewicht verschiebt sich nach rechts. Kinetische Daten erlauben keine weiteren Rückschlüsse auf die Struktur des Übergangszustands und die Natur der elektrophilen Spezies bei der Reaktion der Halogenaddition an die Doppelbindung. Die wertvollsten Informationen über den Mechanismus dieser Reaktion liefern Daten zur Stereochemie der Addition. Die Addition eines Halogens an eine Doppelbindung ist ein stereospezifischer Prozess (ein Prozess, bei dem nur eines der möglichen Stereoisomere gebildet wird; bei einem stereoselektiven Prozess wird die bevorzugte Bildung eines Stereomers beobachtet). Anti-Additionen für Alkene und Cycloalkene, bei denen die Doppelbindung nicht an den Benzolring konjugiert ist. Für cis- Und Trance-Isomere von Buten-2, Penten-2, Hexen-3, Cyclohexen, Cyclopenten und anderen Alkenen, die Addition von Brom erfolgt ausschließlich als Anti- Beitritt. In diesem Fall nur im Fall von Cyclohexen Trance-1,2-Dibromcyclohexan (Enantiomerengemisch).

Die trans-Anordnung der Bromatome in 1,2-Dibromcyclohexan lässt sich relativ zur durchschnittlichen Ebene des Cyclohexanrings (ohne Berücksichtigung) vereinfacht darstellen Konformationen):
Wenn sich Brom mit Cyclohexen verbindet, entsteht zunächst dieses Trance-1,2-Dibromcyclohexan in a,a-Konformation, die sich dann sofort in eine energetisch günstigere umwandelt ihr-Konformation. Anti-Die Addition von Halogenen an eine Doppelbindung ermöglicht es uns, den Mechanismus der einstufigen synchronen Addition eines Halogenmoleküls an eine Doppelbindung abzulehnen, der nur als durchgeführt werden kann syn- Beitritt. Anti-Die Zugabe eines Halogens ist auch nicht mit der Bildung eines offenen Carbokations RCH + -CH 2 Hal als Zwischenprodukt vereinbar. In einem offenen Carbokation ist eine freie Rotation um die C-C-Bindung möglich, was zum Angriff des Br-Anions führen sollte - zur Bildung eines Produktgemisches wie Anti-, so und syn- Beitritte. Stereospezifisch Anti-Der Zusatz von Halogenen war Hauptgrund Schaffung des Konzepts von Bromonium- oder Chloroniumionen als diskreten Zwischenspezies. Dieses Konzept erfüllt die Regel perfekt Anti-Addition, da mit ein nukleophiler Angriff des Halogenidions möglich ist Anti-Seiten an einem der beiden Kohlenstoffatome des Halogenidions über den SN 2 -Mechanismus.

Bei unsymmetrisch substituierten Alkenen sollte dies zu zwei Enantiomeren führen Trio-Form bei Zugabe von Brom zu cis-Isomer oder Enantiomer Erythro-bildet sich bei der Halogenierung Trance-Isomer. Dies wird tatsächlich beobachtet, wenn Brom beispielsweise zu cis- Und Trance-Isomere von Penten-2.




Bei der Bromierung symmetrischer Alkene beispielsweise cis- oder Trance-Hexen-3 sollte gebildet werden oder ein Racemat ( D,L-Form), oder meso-Form des endgültigen Dibromids, was tatsächlich beobachtet wird.




Es gibt unabhängige, direkte Beweise für die Existenz von Halogeniumionen in einer nicht nukleophilen, indifferenten Umgebung bei niedriger Temperatur. Mittels NMR-Spektroskopie wurde die Bildung von Bromoniumionen bei der Ionisierung von 3-Brom-2-methyl-2-fluorbutan unter Einwirkung einer sehr starken Lewis-Säure von Antimonpentafluorid in einer Lösung aus flüssigem Schwefeldioxid bei -80 0 C aufgezeichnet .

Dieses Kation ist bei -80 °C in einer nicht nukleophilen Umgebung recht stabil, wird jedoch durch die Einwirkung nukleophiler Mittel oder beim Erhitzen sofort zerstört.
Zyklische Bromoniumionen können manchmal in reiner Form isoliert werden, wenn sterische Hindernisse ihre Öffnung unter Einwirkung von Nukleophilen verhindern:

Es ist klar, dass die Möglichkeit der Existenz von Bromoniumionen, die unter besonderen Bedingungen recht stabil sind, nicht als direkter Beweis für ihre Bildung bei der Reaktion der Addition von Brom an die Doppelbindung eines Alkens in Alkohol, Essigsäure und anderen Elektronen dienen kann -Spenden von Lösungsmitteln. Solche Daten sollten nur als unabhängige Bestätigung der grundsätzlichen Möglichkeit der Bildung von Halogeniumionen im Prozess der elektrophilen Addition an der Doppelbindung betrachtet werden.
Das Konzept des Halogenidions ermöglicht uns eine rationale Erklärung für die Reversibilität der Addition von Jod an die Doppelbindung. Das Halogenkation verfügt über drei elektrophile Zentren, die einem nukleophilen Angriff durch das Halogenidanion zugänglich sind: zwei Kohlenstoffatome und ein Halogenatom. Im Fall von Chloroniumionen scheint das Cl-Anion bevorzugt oder sogar ausschließlich die Kohlenstoffzentren des Kations anzugreifen. Für das Bromoniumkation sind beide Öffnungsrichtungen des Halogeniumions gleichermaßen wahrscheinlich, sowohl aufgrund des Angriffs des Bromidions an beiden Kohlenstoffatomen als auch am Bromatom. Ein nukleophiler Angriff auf das Bromatom des Bromoniumions führt zu den Ausgangsreagenzien Brom und Alken:

Das Iodoniumion entsteht überwiegend durch den Angriff des Iodidions auf das Iodatom, wodurch das Gleichgewicht zwischen den Ausgangsreagenzien und dem Iodoniumion nach links verschoben wird.

Außerdem, Endprodukt Zusätzlich kann das vicinale Diiodid durch das in der Lösung vorhandene Triiodidanion einen nukleophilen Angriff am Jodatom erfahren, was auch zur Bildung der Ausgangsreagenzien Alken und Jod führt. Mit anderen Worten: Unter den Bedingungen der Additionsreaktion wird das resultierende vicinale Diiodid unter der Wirkung des Triiodid-Anions deiodiert. Vicinale Dichloride und Dibromide dehalogenieren unter den Bedingungen der Addition von Chlor bzw. Brom an Alkene nicht.
Die Antiaddition von Chlor oder Brom ist charakteristisch für Alkene, bei denen die Doppelbindung nicht mit den -Elektronen des Benzolrings konjugiert ist. Für Styrol, Stilben und deren Derivate Anti- Der Beitritt erfolgt und syn-Zugabe eines Halogens, das in polarer Umgebung sogar dominant werden kann.


In Fällen, in denen die Addition eines Halogens an eine Doppelbindung in einer nukleophilen Lösungsmittelumgebung durchgeführt wird, konkurriert das Lösungsmittel effektiv mit dem Halogenidion bei der Öffnung des dreigliedrigen Rings des Halogeniumions:

Die Bildung von Additionsprodukten unter Beteiligung eines Lösungsmittels oder eines anderen „externen“ nukleophilen Mittels wird als konjugierte Additionsreaktion bezeichnet. Wenn Brom und Styrol in Methanol reagieren, entstehen zwei Produkte: vicinales Dibromid und Bromester, deren Verhältnis von der Bromkonzentration in Methanol abhängt
In einer stark verdünnten Lösung dominiert das konjugierte Additionsprodukt, während in einer konzentrierten Lösung im Gegenteil vicinales Dibromid überwiegt. In einer wässrigen Lösung überwiegt immer Halohydrin (ein Alkohol, der ein Halogen am -Kohlenstoffatom enthält) – das Produkt der konjugierten Addition.

ihr-Konformer Trance-2-Chlorcyclohexanol wird durch eine O-H-Wasserstoffbindung weiter stabilisiert . . . Cl. Bei unsymmetrischen Alkenen addiert sich bei konjugierten Additionsreaktionen das Halogen immer an das Kohlenstoffatom mit der größten Anzahl an Wasserstoffatomen und das nukleophile Mittel an den Kohlenstoff mit der geringsten Anzahl an Wasserstoffatomen. Es entsteht kein isomeres Produkt mit einer anderen Anordnung der Verbindungsgruppen. Dies bedeutet, dass das als Zwischenprodukt gebildete zyklische Halogenoniumion eine asymmetrische Struktur mit zwei Bindungen C 1 -Hal und C 2 -Hal haben muss, die sich in Energie und Stärke unterscheiden, und einer großen positiven Ladung am inneren Kohlenstoffatom C 2, die sein kann grafisch auf zwei Arten ausgedrückt:

Daher ist das C2-Kohlenstoffatom des Halogeniumions einem nukleophilen Angriff durch das Lösungsmittel ausgesetzt, obwohl es stärker substituiert und sterisch weniger zugänglich ist.


Eine der besten präparativen Methoden zur Synthese von Bromhydrinen ist die Hydroxybromierung von Alkenen mit N-Bromsuccinimid ( N.B.S.) in einer binären Mischung aus Dimethylsulfoxid ( DMSO) und Wasser.

Diese Reaktion kann in Wasser oder ohne Wasser durchgeführt werden DMSO Allerdings sind die Ausbeuten an Bromhydrinen in diesem Fall etwas geringer.



Die Bildung konjugierter Additionsprodukte bei der Halogenierungsreaktion von Alkenen ermöglicht es uns auch, den synchronen Mechanismus der Addition eines Halogenmoleküls abzulehnen. Die konjugierte Addition an die Doppelbindung steht in guter Übereinstimmung mit einem zweistufigen Mechanismus, an dem das Halogenkation als Zwischenprodukt beteiligt ist.
Für die Reaktion der elektrophilen Addition an eine Doppelbindung sollte man mit einem Anstieg der Reaktionsgeschwindigkeit in Gegenwart elektronenschiebender Alkylsubstituenten und einer Abnahme in Gegenwart elektronenziehender Substituenten an der Doppelbindung rechnen. Tatsächlich steigt die Geschwindigkeit der Addition von Chlor und Brom an die Doppelbindung stark an, wenn von Ethylen zu seinen methylsubstituierten Derivaten übergegangen wird. Beispielsweise ist die Additionsgeschwindigkeit von Brom zu Tetramethylethylen 10 5-mal höher als die Additionsgeschwindigkeit zu 1-Buten. Diese enorme Beschleunigung zeigt deutlich die hohe Polarität des Übergangszustands und den hohen Grad der Ladungstrennung im Übergangszustand und steht im Einklang mit dem eletrophilen Additionsmechanismus.
In einigen Fällen geht die Addition von Chlor an Alkene mit elektronenspendenden Substituenten mit der Abstraktion eines Protons von der Zwischenverbindung anstelle der Addition eines Chloridions einher. Die Abstraktion eines Protons führt zur Bildung eines chlorsubstituierten Alkens, was formal als direkte Substitution mit Doppelbindungswanderung betrachtet werden kann. Experimente mit Isotopentracern deuten jedoch auf eine komplexere Natur der hier ablaufenden Transformationen hin. Bei der Chlorierung von Isobutylen bei 0 0 C entsteht anstelle des erwarteten Dichlorids, dem Additionsprodukt an der Doppelbindung, 2-Methyl-3-chlorpropen (Metallylchlorid).

Formal scheint es, als handele es sich um eine Substitution, nicht um einen Beitritt. Die Untersuchung dieser Reaktion unter Verwendung von Isobutylen, das an Position 1 mit dem 14 C-Isotop markiert ist, zeigte, dass kein direkter Ersatz von Wasserstoff durch Chlor erfolgt, da sich die Markierung im resultierenden Metallylchlorid in der 14 CH 2 Cl-Gruppe befindet. Dieses Ergebnis kann durch die folgende Abfolge von Transformationen erklärt werden:

In einigen Fällen kann es auch zu einer 1,2-Wanderung der Alkylgruppe kommen

In CCl 4 (unpolares Lösungsmittel) ergibt diese Reaktion fast 100 % Dichlorid B- Produkt der gewöhnlichen Addition an einer Doppelbindung (ohne Umlagerung).
Skelettumlagerungen dieser Art sind am charakteristischsten für Prozesse, an denen offene Carbokationen als Zwischenpartikel beteiligt sind. Es ist möglich, dass die Zugabe von Chlor in diesen Fällen nicht über das Chloroniumion erfolgt, sondern über ein kationisches Teilchen in der Nähe des offenen Carbokations. Gleichzeitig ist zu beachten, dass Skelettumlagerungen bei der Addition von Halogenen und gemischten Halogenen an eine Doppelbindung ein eher seltenes Phänomen sind: Sie werden häufiger bei der Addition von Chlor und deutlich seltener bei der Addition von beobachtet Brom. Die Wahrscheinlichkeit solcher Umlagerungen steigt beim Übergang von unpolaren Lösungsmitteln (CCl 4) zu polaren (Nitromethan, Acetonitril).
Fasst man die präsentierten Daten zur Stereochemie, zur konjugierten Addition, zum Einfluss von Substituenten im Alken sowie zu Umlagerungen bei den Additionsreaktionen von Halogenen an der Doppelbindung zusammen, ist festzuhalten, dass sie gut mit dem Mechanismus der elektrophilen Addition übereinstimmen das zyklische Halogeniumion. Auf die gleiche Weise können Daten zur Addition gemischter Halogene an Alkene interpretiert werden, bei denen die Additionsstufen durch die Polarität der Bindung zweier Halogenatome bestimmt werden.
ALKENE
Man bezeichnet Kohlenwasserstoffe, in deren Molekül neben einfachen Kohlenstoff-Kohlenstoff- und Kohlenstoff-Wasserstoff-σ-Bindungen auch Kohlenstoff-Kohlenstoff-π-Bindungen vorhanden sind unbegrenzt. Da die Bildung einer π-Bindung formal dem Verlust von zwei Wasserstoffatomen durch das Molekül entspricht, enthalten ungesättigte Kohlenwasserstoffe 14 Uhr es gibt weniger Wasserstoffatome als die begrenzenden, wo P - Anzahl der π-Bindungen:
Eine Reihe, deren Mitglieder sich um (2H) n voneinander unterscheiden, heißt isologische Reihe. Im obigen Schema sind die Isologen also Hexane, Hexene, Hexadiene, Hexine, Hexatriene usw.
Kohlenwasserstoffe, die eine π-Bindung (d. h. Doppelbindung) enthalten, werden genannt Alkene (Olefine) oder, entsprechend dem ersten Mitglied der Reihe - Ethylen, Ethylenkohlenwasserstoffe. Ihre allgemeine Formel Homologe serie S p N 2l.
1. Nomenklatur
Gemäß den IUPAC-Regeln erhält bei der Benennung von Alkenen die längste Kohlenstoffkette, die eine Doppelbindung enthält, den Namen des entsprechenden Alkans, in dem die Endung steht -ein ersetzt durch -en. Diese Kette wird so nummeriert, dass die an der Bildung der Doppelbindung beteiligten Kohlenstoffatome möglichst niedrige Nummern erhalten:

Radikale werden wie Alkane benannt und nummeriert.
Für Alkene relativ einfacher Struktur sind einfachere Namen zulässig. Daher werden einige der am häufigsten vorkommenden Alkene durch Anhängen des Suffixes benannt -en zum Namen eines Kohlenwasserstoffrestes mit demselben Kohlenstoffgerüst:
Aus Alkenen gebildete Kohlenwasserstoffradikale erhalten das Suffix -enil. Die Nummerierung im Rest beginnt mit dem Kohlenstoffatom, das eine freie Valenz aufweist. Für die einfachsten Alkenylreste dürfen jedoch anstelle systematischer Namen triviale Namen verwendet werden:

Häufig werden Wasserstoffatome genannt, die direkt an ungesättigte Kohlenstoffatome gebunden sind und eine Doppelbindung bilden Vinylwasserstoffatome,
2. Isomerie
Neben der Isomerie des Kohlenstoffgerüsts kommt es in der Reihe der Alkene auch zu einer Isomerie der Position der Doppelbindung. Im Allgemeinen ist diese Art der Isomerie Isomerie der Substituentenposition (Funktion)- wird in allen Fällen beobachtet, wenn das Molekül funktionelle Gruppen enthält. Für das C4H10-Alkan sind zwei Strukturisomere möglich:
Für das C4H8-Alken (Buten) sind drei Isomere möglich:

Buten-1 und Buten-2 sind Isomere der Position der Funktion (in diesem Fall spielt eine Doppelbindung ihre Rolle).
Raumisomere unterscheiden sich in der räumlichen Anordnung der Substituenten zueinander und werden aufgerufen cis-Isomere, wenn sich die Substituenten auf der gleichen Seite der Doppelbindung befinden, und trans-Isomere, wenn auf gegenüberliegenden Seiten:

3. Struktur einer Doppelbindung
Die Spaltungsenergie eines Moleküls an der C=C-Doppelbindung beträgt 611 kJ/mol; Da die Energie der C-C-σ-Bindung 339 kJ/mol beträgt, beträgt die Energie zum Aufbrechen der π-Bindung nur 611-339 = 272 kJ/mol. π-Elektronen sind viel leichter als σ-Elektronen und anfällig für den Einfluss beispielsweise polarisierender Lösungsmittel oder den Einfluss angreifender Reagenzien. Dies wird durch den Unterschied in der Symmetrie der Verteilung der Elektronenwolke von σ- und π-Elektronen erklärt. Die maximale Überlappung der p-Orbitale und damit die minimale freie Energie des Moleküls werden nur bei einer flachen Struktur des Vinylfragments und bei einer Verkürzung realisiert Abstand N-N, gleich 0,134 nm, d.h. deutlich kleiner als der Abstand zwischen Kohlenstoffatomen, die durch eine Einfachbindung verbunden sind (0,154 nm). Wenn sich die „Hälften“ des Moleküls entlang der Doppelbindungsachse relativ zueinander drehen, nimmt der Grad der Orbitalüberlappung ab, was mit dem Energieverbrauch verbunden ist. Die Folge davon ist das Fehlen einer freien Rotation entlang der Doppelbindungsachse und die Existenz geometrischer Isomere mit entsprechender Substitution an den Kohlenstoffatomen.
4. Physikalische Eigenschaften
Die niederen Homologen einiger einfachster Alkene sind wie Alkane unter Normalbedingungen Gase und ab C 5 niedrigsiedende Flüssigkeiten.

Alle Alkene sind wie Alkane in Wasser praktisch unlöslich und in anderen organischen Lösungsmitteln gut löslich, mit Ausnahme von Methylalkohol; Sie alle haben eine geringere Dichte als Wasser.
5. Chemische Eigenschaften
Bei der Betrachtung der Reaktivität komplexer organischer Verbindungen gilt: allgemeines Prinzip. Bei den meisten Reaktionen ist nicht der „inerte“ Kohlenwasserstoffrest beteiligt, sondern die vorhandenen funktionellen Gruppen und deren unmittelbare Umgebung. Dies ist natürlich, da die meisten Verbindungen weniger stark sind S-S-Verbindungen und C-H, und außerdem sind die Bindungen in und in der Nähe der funktionellen Gruppe am stärksten polarisiert.
Es ist natürlich zu erwarten, dass die Reaktionen von Alkenen über eine Doppelbindung ablaufen, die auch als funktionelle Gruppe angesehen werden kann, und es sich daher um Additionsreaktionen und nicht um Substitutionsreaktionen handelt, die für die zuvor betrachteten Alkane charakteristisch sind.
Wasserstoffzugabe
Die Anlagerung von Wasserstoff an Alkene führt zur Bildung von Alkanen:
Die Anlagerung von Wasserstoff an Ethylenverbindungen in Abwesenheit von Katalysatoren erfolgt nur bei hohen Temperaturen, bei denen häufig die Zersetzung organischer Substanzen beginnt. Die Anlagerung von Wasserstoff erfolgt wesentlich einfacher in Gegenwart von Katalysatoren. Die Katalysatoren sind Metalle der Platingruppe in fein verteiltem Zustand, Platin selbst und insbesondere Palladium – bereits bei gewöhnlichen Temperaturen. Von großer praktischer Bedeutung war die Entdeckung von Sabatier, der speziell hergestelltes, fein zerkleinertes Nickel bei einer Temperatur von 150–300 °C verwendete und in zahlreichen Arbeiten die Vielseitigkeit dieses Katalysators für eine Reihe von Reduktionsreaktionen demonstrierte.
Zusatz von Halogenen
Halogene addieren sich zu Alkenen und bilden Dihalogenderivate, die Halogenatome an benachbarten Kohlenstoffatomen enthalten:

In der ersten Stufe dieser Reaktion kommt es zu einer Wechselwirkung zwischen den π-Elektronen der Doppelbindung und der elektrophilen Halogenspezies unter Bildung des π-Komplexes (I). Anschließend wird der π-Komplex unter Abspaltung des Halogenanions, das im Gleichgewicht mit dem Carbokation (III) steht, in das Onium(Bromnium)-Ion (II) umgelagert. Das Anion greift dann das Oniumion an und bildet das Additionsprodukt (IV):

Der Anionenangriff des Bromoniumions (II) zur Bildung von Dibromid (IV) erfolgt in der trans-Position. Somit entsteht bei der Addition von Br 2 an Cyclopenten nur trans-1,2-Dibromdiclopentan:

Ein Beweis für die zweistufige Addition eines Halogens an Alkene ist die Tatsache, dass bei der Addition von Br 2 an Cyclohexen in Gegenwart von NaCl nicht nur trans-1,2-Dibromcyclohexan, sondern auch trans-1-Brom-2-chlorcyclohexan entsteht gebildet:

Radikalische Halogenierung
Unter rauen Bedingungen (Gasphase, 500 °C) addieren sich Halogene nicht an die Doppelbindung, sondern es kommt zu einer Halogenierung der α-Position:
In diesem Fall folgt die Reaktion einem radikalischen Mechanismus.
Zugabe von Halogenwasserstoffen
Halogenwasserstoffe addieren sich zu Alkenen und bilden Alkylhalogenide. Bei asymmetrischen Molekülen folgt die Addition der Markownikow-Regel, d. h. Wasserstoff lagert sich an das am stärksten hydrierte Kohlenstoffatom (mit der größten Anzahl an Wasserstoffatomen) an:
Diese Reaktion findet wie die Addition von Brom an Ethylen nach der Bildung des π-Komplexes über die Stufe der Bildung des Protoniumions statt:

In Gegenwart von Peroxiden fügt sich gemäß der Markownikow-Regel kein Bromwasserstoff hinzu (Kharash-Effekt):
In Gegenwart von Peroxiden verläuft die Reaktion nicht wie oben über den Mechanismus der elektrophilen Addition, sondern über einen radikalischen Mechanismus. Die erste Stufe ist der Angriff des Peroxidradikals auf das HBr-Molekül:
Das resultierende Bromradikal addiert sich an Propylen und bildet ein neues Radikal:

Letzteres wird durch die Austreibung von Wasserstoff aus einem neuen HBr-Molekül mit der Regenerierung eines neuen Bromradikals usw. stabilisiert:
Und in diesem Fall wird die Richtung des Prozesses durch die Stabilität der Brompropanradikale bestimmt: Überwiegend wird das stabilere gebildet, was zu 1-Brompropan führt.
Zugabe von Wasser und Schwefelsäure
In Gegenwart von Säuren addiert Wasser nach der Markownikow-Regel an die Doppelbindung:
Die gleiche Reaktion findet mit Schwefelsäure statt:
Oxidation mit Kaliumpermanganat in neutraler oder leicht alkalischer Umgebung (Wagner-Reaktion)
Im ersten Schritt erfolgt nach dem cis-Additionsmechanismus die Addition des MnO 4 -Ions an die Mehrfachbindung, gefolgt von der hydrolytischen Spaltung des instabilen Additionsprodukts und der Freisetzung des MnO 3 --Ions.

Die Reaktion folgt dem cis-Additionsschema:

Saure Permanganatlösungen oxidieren Alkene unter Kettenspaltung an der C=C-Bindung und der Bildung von Säuren oder Ketonen:
Wirkung von Ozon auf Alkene
Diese Reaktion führt zu kristallinen, hochexplosiven Ozoniden, die bei der Hydrolyse Aldehyde oder Ketone bilden:

Die Reaktion wird oft genutzt, um die Position der Doppelbindung in einem Molekül zu bestimmen, da man sich aus den gebildeten Carbonylverbindungen die Struktur des ursprünglichen Alkens vorstellen kann.
Die Reaktion verläuft durch cis-Cycloaddition über die Stufe des instabilen Molozonids, das einer Dissoziation und anschließenden Rekombination unterliegt:

Polymerisation von Alkenen
Von besonderer Bedeutung ist die Polymerisation von Ethylen und Propylen zu Polymeren mit einem Molekulargewicht von etwa 10 5. Bis 1953 wurde hauptsächlich die radikalische (durch freie Radikale initiierte) Polymerisation eingesetzt, obwohl grundsätzlich sowohl eine anionische als auch eine kationische Initiierung des Prozesses zum Einsatz kam.
Nach der Arbeit von Ziegler und Nutt, die für diese Studien den Nobelpreis erhielten, wurde das sogenannte Koordinationspolymerisation. Der einfachste „Ziegler“-Katalysator dieser Art besteht aus Triethylaluminium- und Titan(IV)-Verbindungen. Dabei entstehen Polymere mit hochgradig Stereoregularität. Beispielsweise entsteht bei der Polymerisation von Propylen isotaktisches Polypropylen – ein Polymer, bei dem alle CH 3 -Seitengruppen die gleiche räumliche Position einnehmen:

Dadurch erhält das Polymer eine höhere Festigkeit und kann sogar zur Herstellung synthetischer Fasern verwendet werden.
Das mit dieser Methode gewonnene Polyethylen ist ein gesättigter Kohlenwasserstoff mit gerader Kette. Es ist weniger elastisch als bei hohen Drücken hergestelltes Polyethylen, weist jedoch eine höhere Härte auf und hält höheren Temperaturen stand.
Aufgrund der Kombination vieler wertvoller Eigenschaften findet Polyethylen ein sehr breites Anwendungsspektrum. Es ist eines der besten Materialien zur Kabelisolierung, für den Einsatz in der Radartechnik, Funktechnik, Landwirtschaft usw. Daraus werden Rohre, Schläuche, Behälter, Behälter für landwirtschaftliche Produkte und Düngemittel, Folien unterschiedlicher Dicke und viele Haushaltsgegenstände hergestellt. Langlebige Polyethylenfolien werden mittlerweile sogar als Beschichtung für den Boden künstlicher Kanäle verwendet, um diese wasserdicht zu machen.
Telomerisierung
Ein interessantes industriell genutztes Verfahren ist die Copolymerisation von Ethylen mit Tetrachlorkohlenstoff, genannt Telomerisierung. Wenn Benzoylperoxid oder ein anderer unter Bildung freier Radikale zerfallender Initiator zu einer Mischung aus Ethylen und CC14 gegeben wird, läuft folgender Prozess ab:
CC1 3"-Radikale initiieren die Kettenpolymerisation von Ethylen:
Wenn es auf ein anderes CC1 4-Molekül trifft, stoppt das Kettenwachstum:
Radikal CC1 3 – führt zu einer neuen Kette.
Die resultierenden Polymerisationsprodukte mit niedrigem Molekulargewicht, die an den Enden der Kette Halogenatome enthalten, werden als bezeichnet Telomere. Telomere mit erhaltenen Werten n =2,3, 4, ...,15.
Bei der Hydrolyse von Telomerisationsprodukten entstehen ω-chlorsubstituierte Carbonsäuren, die wertvolle chemische Produkte sind.
Allgemeine Formel von Alkenen: CnH2n(n 2)
Die ersten Vertreter der homologen Reihe von Alkenen:

Die Formeln der Alkene lassen sich aus den entsprechenden Formeln der Alkane (gesättigte Kohlenwasserstoffe) zusammenstellen. Die Namen von Alkenen werden gebildet, indem das Suffix -an des entsprechenden Alkans durch -en oder –ylen ersetzt wird: Butan – Butylen, Pentan – Penten usw. Die Nummer des Kohlenstoffatoms mit Doppelbindung wird durch eine arabische Ziffer hinter dem Namen angegeben.
Die an der Bildung einer Doppelbindung beteiligten Kohlenstoffatome befinden sich im Zustand der sp-Hybridisierung. Drei Bindungen werden durch Hybridorbitale gebildet und liegen in derselben Ebene in einem Winkel von 120° zueinander. Eine zusätzliche -Bindung entsteht durch seitliche Überlappung nicht-hybrider p-Orbitale:

Die Länge der C=C-Doppelbindung (0,133 nm) ist kürzer als die Länge der Einfachbindung (0,154 nm). Die Energie einer Doppelbindung ist weniger als doppelt so groß wie die Energie einer Einfachbindung, da die Energie der -Bindung geringer ist als die Energie der -Bindung.
Alkenisomere
Alle Alkene außer Ethylen haben Isomere. Alkene zeichnen sich durch Isomerie des Kohlenstoffgerüsts, Isomerie der Position der Doppelbindung, Interklassen- und Raumisomerie aus.
Das Interklassenisomer von Propen (C 3 H 6) ist Cyclopropan. Beginnend mit Buten (C 4 H 8) zeigt sich die Isomerie anhand der Position der Doppelbindung (Buten-1 und Buten-2), der Isomerie des Kohlenstoffgerüsts (Methylpropen oder Isobutylen) sowie der räumlichen Isomerie (cis-Buten- 2 und trans-Buten-2 ). Bei cis-Isomeren befinden sich die Substituenten auf einer Seite und bei trans-Isomeren auf gegenüberliegenden Seiten der Doppelbindung.
Die chemischen Eigenschaften und die chemische Aktivität von Alkenen werden durch das Vorhandensein einer Doppelbindung in ihren Molekülen bestimmt. Die typischsten Reaktionen für Alkene sind elektrophile Additionen: Hydrohalogenierung, Hydratation, Halogenierung, Hydrierung, Polymerisation.
Qualitative Reaktion auf eine Doppelbindung – Verfärbung von Bromwasser:
Beispiele zur Lösung von Problemen zum Thema „Formel der Alkene“
BEISPIEL 1
| Übung | Wie viele Isomere, die Bromwasser entfärben können, hat ein Stoff mit der Zusammensetzung C 3 H 5 Cl? Schreiben Strukturformeln diese Isomere |
| Lösung | C 3 H 5 Cl ist ein Monochlorderivat des Kohlenwasserstoffs C 3 H 6 . Diese Formel entspricht entweder Propen, einem Kohlenwasserstoff mit einer Doppelbindung, oder Cyclopropan (einem zyklischen Kohlenwasserstoff). Dieser Stoff verfärbt Bromwasser, was bedeutet, dass es eine Doppelbindung enthält. Drei Kohlenstoffatome können nur diese Struktur bilden: da bei einer solchen Anzahl von Kohlenstoffatomen eine Isomerie des Kohlenstoffgerüsts und der Position der Doppelbindung unmöglich ist. Strukturisomerie in einem bestimmten Molekül ist nur aufgrund einer Änderung der Position des Chloratoms relativ zur Doppelbindung möglich: Für 1-Chlorpropen ist eine cis-trans-Isomerie möglich: |
| Antwort | Die Problembedingungen werden von 4 Isomeren erfüllt |
BEISPIEL 2
| Übung | Ein Gemisch isomerer Kohlenwasserstoffe (Gase mit einer Wasserstoffdichte von 21) mit einem Volumen von 11,2 Litern (Nr.) reagierte mit Bromwasser. Es resultierten 40,4 g des entsprechenden Dibromderivats. Welche Struktur haben diese Kohlenwasserstoffe? Bestimmen Sie ihren Volumengehalt in der Mischung (in %). |
| Lösung | Die allgemeine Formel der Kohlenwasserstoffe lautet C x H y. Rechnen wir Molmasse Kohlenwasserstoffe: Daher lautet die Formel der Kohlenwasserstoffe C 3 H 6. Nur zwei Stoffe haben diese Formel – Propen und Cyclopropan. Nur Propen reagiert mit Bromwasser: Berechnen wir die Menge an Dibromderivat-Substanz: Nach der Reaktionsgleichung: n(Propen) mol Die Gesamtmenge an Kohlenwasserstoffen im Gemisch beträgt: |