
Fysische en chemische eigenschappen van alkenen. Algemene formule van alkenen. Eigenschappen en kenmerken van alkenen
Alkenen zijn chemisch actief. Hun Chemische eigenschappen worden grotendeels bepaald door de aanwezigheid van een dubbele binding. De meest voorkomende reacties voor alkenen zijn elektrofiele additie- en radicaaladditiereacties. Nucleofiele additiereacties vereisen gewoonlijk de aanwezigheid van een sterke nucleofiel en zijn niet typisch voor alkenen. Alkenen ondergaan gemakkelijk oxidatie- en additiereacties en zijn ook in staat tot alylradicaalsubstitutie.
Toevoegingsreacties
Hydrogenering De toevoeging van waterstof (hydrogeneringsreactie) aan alkenen wordt uitgevoerd in aanwezigheid van katalysatoren. Meestal worden gebroken metalen gebruikt - platina, nikkel, palladium, enz. Als resultaat worden de overeenkomstige alkanen (verzadigde koolwaterstoffen) gevormd.
$CH_2=CH_2 + H2 → CH_3–CH_3$
Toevoeging van halogenen. Alkenen reageren onder normale omstandigheden gemakkelijk met chloor en broom om de overeenkomstige dihalogeenalkanen te vormen, waarin halogeenatomen zich op aangrenzende koolstofatomen bevinden.
Notitie 1
Wanneer alkenen een interactie aangaan met broom, verkleurt broom tot een geelbruine kleur. Dit is een van de oudste en eenvoudigste kwalitatieve reacties met onverzadigde koolwaterstoffen, aangezien alkynen en alkadiënen ook op dezelfde manier reageren.
$CH_2=CH_2 + Br_2 → CH_2Br–CH_2Br$
Toevoeging van waterstofhalogeniden. Wanneer ethyleenkoolwaterstoffen reageren met waterstofhalogeniden ($HCl$, $HBr$), worden haloalkanen gevormd; de richting van de reactie hangt af van de structuur van de alkenen.
In het geval van ethyleen of symmetrische alkenen vindt de additiereactie ondubbelzinnig plaats en leidt deze tot de vorming van slechts één product:
$CH_2=CH_2 + HBr → CH_3–CH_2Br$
Bij asymmetrische alkenen is de vorming van twee verschillende additiereactieproducten mogelijk:
Opmerking 2
In feite wordt er hoofdzakelijk slechts één reactieproduct gevormd. Het patroon in de richting van dergelijke reacties werd vastgesteld door de Russische chemicus V.V. Markovnikov in 1869 Het wordt de heerschappij van Markovnikov genoemd. Wanneer waterstofhalogeniden interageren met asymmetrische alkenen, wordt een waterstofatoom toegevoegd op de plaats van de splitsing van de dubbele binding in het meest gehydrogeneerde koolstofatoom, dat wil zeggen voordat het wordt verbonden met grote hoeveelheid waterstof atomen.
Markovnikov formuleerde deze regel op basis van experimentele gegevens en kreeg pas veel later een theoretische rechtvaardiging. Beschouw de reactie van propyleen met waterstofchloride.
Een van de kenmerken van de $p$-obligatie is dat deze gemakkelijk gepolariseerd kan worden. Onder invloed van de methylgroep (positief inductief effect + $I$) in het propeenmolecuul verschuift de elektronendichtheid van de $p$ binding naar één van de koolstofatomen (= $CH_2$). Als gevolg hiervan verschijnt er een gedeeltelijke negatieve lading ($\delta -$). Er verschijnt een gedeeltelijke positieve lading ($\delta +$) op het andere koolstofatoom van de dubbele binding.
Deze verdeling van de elektronendichtheid in het propyleenmolecuul bepaalt de locatie van de toekomstige protonenaanval. Dit is het koolstofatoom van de methyleengroep (= $CH_2$), dat een gedeeltelijk negatieve $\delta-$ lading draagt. En chloor valt dienovereenkomstig een koolstofatoom aan met een gedeeltelijke positieve lading $\delta+$.
Als gevolg hiervan is het belangrijkste product van de reactie van propeen met waterstofchloride 2-chloorpropaan.
Hydratatie
Hydratatie van alkenen vindt plaats in aanwezigheid van minerale zuren en voldoet aan de regel van Markovnikov. De reactieproducten zijn alcoholen
$CH_2=CH_2 + H_2O → CH_3–CH_2–OH$
Alkylering
Toevoeging van alkanen aan alkenen in aanwezigheid van een zure katalysator ($HF$ of $H_2SO_4$) bij lage temperaturen leidt tot de vorming van koolwaterstoffen met een hoger molecuulgewicht en wordt in de industrie vaak gebruikt voor de productie van motorbrandstof
$R–CH_2=CH_2 + R’–H → R–CH_2–CH_2–R’$
Oxidatie reacties
Oxidatie van alkenen kan plaatsvinden, afhankelijk van de omstandigheden en soorten oxiderende reagentia, zowel bij het splitsen van de dubbele binding als bij het behoud van het koolstofskelet:
Polymerisatiereacties
Alkeenmoleculen kunnen onder bepaalde omstandigheden aan elkaar worden toegevoegd door het openen van $\pi$-bindingen en de vorming van dimeren, trimmeren of verbindingen met een hoog molecuulgewicht: polymeren. Polymerisatie van alkenen kan plaatsvinden via een vrije radicaal- of een kation-anionmechanisme. Zuren, peroxiden, metalen, enz. Worden gebruikt als polymerisatie-initiatoren en worden ook uitgevoerd onder invloed van temperatuur, bestraling en druk. Een typisch voorbeeld is de polymerisatie van ethyleen tot polyethyleen
$nCH_2=CH_2 → (–CH_2–CH_(2^–))_n$
Vervangingsreacties
Substitutiereacties zijn niet typisch voor alkenen. Echter, wanneer hoge temperaturen(boven 400 ° C) radicaaladditiereacties, die omkeerbaar zijn, worden onderdrukt. In dit geval wordt het mogelijk om het waterstofatoom dat zich in de allylische positie bevindt te vervangen terwijl de dubbele binding behouden blijft
$CH_2=CH–CH_3 + Cl_2 – CH_2=CH–CH_2Cl + HCl$
Alkenen worden voornamelijk gekenmerkt door reacties toetreding via een dubbele binding. In principe verlopen deze reacties via een ionisch mechanisme. De pi-binding wordt verbroken en er worden twee nieuwe sigma-bindingen gevormd. Laat me je eraan herinneren dat substitutiereacties typisch waren voor alkanen en dat ze een radicaal mechanisme volgden. Waterstofmoleculen kunnen zich hechten aan alkenen; deze reacties worden hydrogenering, watermoleculen, hydratatie, halogenering van halogenen en hydrohalogenering van waterstofhalogeniden genoemd. Maar eerst dingen eerst.
Additiereacties met dubbele bindingen
Dus, Eerst chemische eigenschap vermogen om waterstofhalogeniden toe te voegen, hydrohalogenering.
Propeen en andere alkenen reageren met waterstofhalogeniden volgens de regel van Markovnikov.

Een waterstofatoom hecht zich aan het meest gehydrogeneerde, of beter gezegd gehydrogeneerde, koolstofatoom.
Seconde nummer op onze lijst met eigenschappen zou hydratatie zijn, de toevoeging van water.
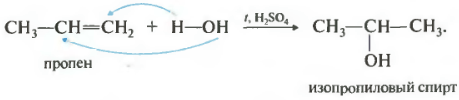
De reactie vindt plaats bij verhitting in aanwezigheid van een zuur, meestal zwavelzuur of fosforzuur. De toevoeging van water gebeurt ook volgens de regel van Markovnikov, dat wil zeggen dat primaire alcohol alleen kan worden verkregen door hydratatie van ethyleen, de resterende onvertakte alkenen geven secundaire alcoholen.
Er zijn uitzonderingen op de regel van Markovnikov voor zowel hydrohalogenering als hydratatie. Ten eerste vindt de toevoeging, in tegenstelling tot deze regel, plaats in aanwezigheid van peroxiden.
Ten tweede voor derivaten van alkenen waarin elektronenzuigende groepen aanwezig zijn. Bijvoorbeeld voor 3,3,3-trifluorpropeen-1.

Fluoratomen trekken vanwege hun hoge elektronegativiteit elektronendichtheid naar zich toe langs een keten van sigmabindingen. Dit fenomeen wordt een negatief inductief effect genoemd.

Hierdoor worden de mobiele pi-elektronen van de dubbele binding verplaatst en krijgt het buitenste koolstofatoom een gedeeltelijk positieve lading, die meestal wordt aangeduid als delta plus. Hierheen zal het negatief geladen broomion gaan, en het waterstofkation zal zich hechten aan het minst gehydrogeneerde koolstofatoom.
Naast de trifluormethylgroep hebben bijvoorbeeld de trichloormethylgroep, de nitrogroep, de carboxylgroep en enkele andere een negatief inductief effect.
Dit tweede geval van overtreding van de Markovnikov-regel in het Unified State Exam is zeer zeldzaam, maar het is toch raadzaam om er rekening mee te houden als u van plan bent het examen met de maximale score te halen.
Derde chemische eigenschap van halogeenmoleculen.

Het gaat hier vooral om broom, aangezien deze reactie kwalitatief is voor een meervoudige binding. Wanneer bijvoorbeeld ethyleen door broomwater wordt geleid, dat wil zeggen een oplossing van broom in water dat bruin van kleur is, verkleurt het. Als je een mengsel van gassen, bijvoorbeeld ethaan en etheen, door broomwater laat stromen, kun je zuiver ethaan krijgen zonder etheenonzuiverheden, omdat het in de reactiekolf achterblijft in de vorm van dibroomethaan, dat een vloeistof is.
Van bijzonder belang is de reactie van alkenen in de gasfase bij sterke verwarming, bijvoorbeeld met chloor.
Onder dergelijke omstandigheden vindt er geen additiereactie plaats, maar een substitutiereactie. Bovendien uitsluitend op het alfakoolstofatoom, dat wil zeggen het atoom grenzend aan de dubbele binding. In dit geval wordt 3-chloorpropeen-1 verkregen. Deze reacties komen niet vaak voor tijdens het examen, dus de meeste studenten onthouden ze niet en maken in de regel fouten.
Vierde nummer is de hydrogeneringsreactie, en daarmee de dehydrogeneringsreactie. Dat wil zeggen, de toevoeging of verwijdering van waterstof.

Hydrogenering vindt plaats bij een niet erg hoge temperatuur op een nikkelkatalysator. Bij hogere temperaturen is dehydrogenering mogelijk om alkynen te produceren.
Vijfde Een eigenschap van alkenen is het vermogen om te polymeriseren, wanneer honderden en duizenden alkeenmoleculen zeer lange en sterke ketens vormen als gevolg van het verbreken van de pi-binding en de vorming van sigma-bindingen met elkaar.
In dit geval was het resultaat polyethyleen. Houd er rekening mee dat het resulterende molecuul geen meerdere bindingen bevat. Dergelijke stoffen worden polymeren genoemd, de oorspronkelijke moleculen worden monomeren genoemd, het zich herhalende fragment is de elementaire eenheid van het polymeer en het getal n is de polymerisatiegraad.
Reacties om andere belangrijke polymere materialen te produceren, zoals polypropyleen, zijn ook mogelijk.


Een ander belangrijk polymeer is polyvinylchloride.

Het uitgangsmateriaal voor de productie van dit polymeer is chlooretheen, waarvan de algemene naam vinylchloride is. Omdat deze onverzadigde substituent vinyl wordt genoemd. Een veel voorkomende afkorting op plastic PVC-producten staat gewoon voor polyvinylchloride.
We bespraken vijf eigenschappen die additiereacties met dubbele bindingen vertegenwoordigden. Laten we nu eens naar de reacties kijken oxidatie.
Alkeenoxidatiereacties
Zesde chemische eigenschap in onze algemene lijst is milde oxidatie of Wagner-reactie. Het komt voor wanneer een alkeen in de kou wordt blootgesteld aan een waterige oplossing van kaliumpermanganaat. Daarom wordt bij examentaken vaak een temperatuur van nul graden aangegeven.
Het resultaat is tweewaardige alcohol. In dit geval ethyleenglycol, maar over het algemeen zijn dergelijke alcoholen dat ook gemeenschappelijke naam glycolen Tijdens de reactie verkleurt de paarsroze permanganaatoplossing, dus deze reactie is ook kwalitatief voor een dubbele binding. Mangaan wordt in een neutraal milieu gereduceerd van oxidatietoestand +7 naar oxidatietoestand +4. Laten we nog een paar voorbeelden bekijken. DE VERGELIJKING
Hier krijgen we propaandiol-1,2. Cyclische alkenen zullen echter op dezelfde manier reageren. DE VERGELIJKING
Een andere optie is wanneer de dubbele binding zich bijvoorbeeld in de zijketen van aromatische koolwaterstoffen bevindt. Regelmatig binnen examen opdrachten Er is een Wagner-reactie waarbij styreen betrokken is, de tweede naam is vinylbenzeen.

Ik hoop dat ik genoeg voorbeelden heb gegeven zodat je begrijpt dat de milde oxidatie van een dubbele binding altijd een vrij eenvoudige regel volgt: de pi-binding wordt verbroken en aan elk koolstofatoom wordt een hydroxygroep toegevoegd.
Nu wat betreft harde oxidatie. Het zal van ons zijn zevende eigendom. Deze oxidatie vindt plaats wanneer een alkeen bij verhitting reageert met een zure oplossing van kaliumpermanganaat.
De vernietiging van het molecuul vindt plaats, dat wil zeggen de vernietiging ervan bij de dubbele binding. In het geval van buteen-2 werden twee moleculen azijnzuur verkregen. Over het algemeen kan de positie van de meervoudige binding in de koolstofketen worden beoordeeld aan de hand van de oxidatieproducten.
De oxidatie van buteen-1 produceert een molecuul propionzuur (propaanzuur) en koolstofdioxide.
In het geval van ethyleen krijg je twee moleculen koolstofdioxide. In alle gevallen wordt mangaan in een zure omgeving teruggebracht van oxidatietoestand +7 naar +2.
En tenslotte achtste eigenschap volledige oxidatie of verbranding.
Alkenen verbranden, net als andere koolwaterstoffen, tot kooldioxide en water. Laten we de vergelijking voor de verbranding van alkenen in schrijven algemeen beeld.
Er zullen net zoveel kooldioxidemoleculen zijn als er koolstofatomen in het alkeenmolecuul zijn, aangezien het CO 2 -molecuul één koolstofatoom bevat. Dat wil zeggen, n CO 2 moleculen. Er zullen twee keer minder watermoleculen zijn dan waterstofatomen, dat wil zeggen 2n/2, wat gewoon n betekent.
Links en rechts bevinden zich evenveel zuurstofatomen. Aan de rechterkant zijn er 2n koolstofdioxide plus n water, voor een totaal van 3n. Aan de linkerkant bevinden zich hetzelfde aantal zuurstofatomen, wat betekent dat er twee keer minder moleculen zijn, omdat het molecuul twee atomen bevat. Dat wil zeggen, 3n/2 zuurstofmoleculen. Je kunt 1,5n schrijven.
Wij hebben beoordeeld acht chemische eigenschappen van alkenen.
4. Chemische eigenschappen van alkenen
De energie van een dubbele koolstof-koolstofbinding in ethyleen (146 kcal/mol) blijkt aanzienlijk lager te zijn dan tweemaal de energie van een enkele C-C-binding in ethaan (2,88 = 176 kcal/mol). De -C-binding in ethyleen is sterker dan de -binding, daarom zijn reacties van alkenen die gepaard gaan met de splitsing van de -binding met de vorming van twee nieuwe eenvoudige -bindingen een thermodynamisch gunstig proces. In de gasfase zijn volgens berekende gegevens bijvoorbeeld alle onderstaande reacties exotherm met een significante negatieve enthalpie, ongeacht hun feitelijke mechanisme.
Vanuit het oogpunt van de theorie van moleculaire orbitalen kan ook worden geconcludeerd dat de -binding reactiever is dan de -binding. Laten we eens kijken naar de moleculaire orbitalen van ethyleen (Fig. 2).

De bindende orbitaal van ethyleen heeft inderdaad een hogere energie dan de bindende orbitaal, en omgekeerd ligt de antibindende * orbitaal van ethyleen onder de antibindende * orbitaal van de C=C-binding. Onder normale omstandigheden zijn de *- en *-orbitalen van ethyleen leeg. Bijgevolg zullen de grensorbitalen van ethyleen en andere alkenen, die hun reactiviteit bepalen, -orbitalen zijn.
4.1. Katalytische hydrogenering van alkenen
Ondanks het feit dat de hydrogenering van ethyleen en andere alkenen tot alkanen gepaard gaat met het vrijkomen van warmte, vindt deze reactie alleen merkbaar plaats in aanwezigheid van bepaalde katalysatoren. De katalysator heeft per definitie geen invloed op het thermische effect van de reactie en zijn rol wordt beperkt tot het verminderen van de activeringsenergie. Er moet onderscheid worden gemaakt tussen heterogene en homogene katalytische hydrogenering van alkenen. Bij heterogene hydrogenering worden fijngemalen metaalkatalysatoren gebruikt - platina, palladium, ruthenium, rhodium, osmium en nikkel, hetzij in zuivere vorm of gedragen op inerte dragers - BaSO 4, CaCO 3, actieve kool, Al 2 O 3, enz. Alle daarvan zijn onoplosbaar in organische media en werken als heterogene katalysatoren. De meest actieve daarvan zijn ruthenium en rhodium, maar platina en nikkel zijn het meest wijdverspreid. Platina wordt meestal gebruikt in de vorm van zwartdioxide PtO 2, algemeen bekend als Adams-katalysator. Platinadioxide wordt verkregen door chloorplatinazuur H 2 PtCl 6 te smelten. 6H 2 O of ammoniumhexachloorplatinaat (NH 4) 2 PtCl 6 met natriumnitraat. De hydrogenering van alkenen met een Adams-katalysator wordt gewoonlijk uitgevoerd bij normale druk en een temperatuur van 20-50°C in alcohol, azijnzuur, ethylacetaat. Wanneer waterstof wordt doorgeleid, wordt platinadioxide direct in het reactievat gereduceerd tot platinazwart, wat de hydrogenering katalyseert. Andere actievere metalen uit de platinagroep worden gebruikt op inerte dragers, bijvoorbeeld Pd/C of Pd/BaSO 4, Ru/Al 2 O 3; Rh/C, enz. Palladium op steenkool katalyseert de hydrogenering van alkenen tot alkanen in een alcoholoplossing bij 0-20°C en normale druk. Nikkel wordt meestal gebruikt in de vorm van zogenaamd "Raney-nikkel". Om deze katalysator te verkrijgen wordt een nikkel-aluminiumlegering behandeld met hete waterige alkali om vrijwel al het aluminium te verwijderen, en vervolgens met water tot een neutrale reactie ontstaat. De katalysator heeft een poreuze structuur en wordt daarom ook wel skeletnikkelkatalysator genoemd. Typische omstandigheden voor de hydrogenering van alkenen boven Raney-nikkel vereisen het gebruik van een druk in de orde van 5-10 atm en een temperatuur van 50-100 ° C, dat wil zeggen dat deze katalysator veel minder actief is dan metalen uit de platinagroep, maar goedkoper is. . Hieronder staan enkele typische voorbeelden van heterogene katalytische hydrogenering van acyclische en cyclische alkenen:


Omdat beide waterstofatomen vanaf het oppervlak van het katalysatormetaal aan de koolstofatomen van de dubbele binding worden toegevoegd, vindt de toevoeging gewoonlijk aan één kant van de dubbele binding plaats. Dit type verbinding wordt genoemd syn- toetreding. In gevallen waarin twee reagensfragmenten worden toegevoegd aan verschillende zijden van een meervoudige binding (dubbel of drievoudig), anti- toetreding. Voorwaarden syn- En anti- zijn qua betekenis gelijkwaardig aan de termen cis- En trance-. Om verwarring en misverstanden over de voorwaarden te voorkomen syn- En anti- raadpleeg het type verbinding en de voorwaarden cis- En trance- aan de structuur van het substraat.
De dubbele binding in alkenen wordt sneller gehydrogeneerd in vergelijking met veel andere functionele groepen (C=O, COOR, CN, enz.) en daarom is de hydrogenering van de dubbele binding C=C vaak een selectief proces als de hydrogenering wordt uitgevoerd. in milde omstandigheden(0-20 0 C en om luchtdruk). Hieronder vindt u enkele typische voorbeelden:


De benzeenring wordt onder deze omstandigheden niet gereduceerd.
Een belangrijke en fundamenteel belangrijke prestatie op het gebied van katalytische hydrogenering is de ontdekking van oplosbare metaalcomplexen die de hydrogenering in een homogene oplossing katalyseren. Heterogene hydrogenering op het oppervlak van metaalkatalysatoren heeft een aantal belangrijke nadelen, zoals isomerisatie van alkenen en splitsing van afzonderlijke koolstof-koolstofbindingen (hydrogenolyse). Homogene hydrogenering heeft deze nadelen niet. Achter afgelopen jaren Er is een grote groep homogene hydrogeneringskatalysatoren - overgangsmetaalcomplexen die verschillende liganden bevatten - verkregen. De beste katalysatoren voor homogene hydrogenering zijn complexen van rhodium (I) en ruthenium (III) chloriden met trifenylfosfine - tris(trifenylfosfine)rhodiumchloride (Ph 3 P) 3 RhCl (Wilkinson's katalysator) en tris(trifenylfosfine) rutheniumhydrochloride (Ph 3 P). ) 3 RuHCl. Het meest toegankelijke rhodiumcomplex wordt verkregen door rhodium(III)chloride te laten reageren met trifenylfosfine. Wilkinson's rhodiumcomplex wordt gebruikt om de dubbele binding onder normale omstandigheden te hydrogeneren.

Een belangrijk voordeel van homogene katalysatoren is het vermogen om selectief een mono- of digesubstitueerde dubbele binding te reduceren in aanwezigheid van een tri- en tetra-gesubstitueerde dubbele binding vanwege de grote verschillen in hun hydrogeneringssnelheden.

Bij homogene katalysatoren vindt ook waterstoftoevoeging plaats syn- toetreding. Herstel dus cis-buteen-2 met deuterium leidt onder deze omstandigheden tot meso-2,3-dideuterobutaan.

4.2. Reductie van een dubbele binding met diimide
De reductie van alkenen tot de overeenkomstige alkanen kan met succes worden bereikt met behulp van diimide NH=NH.
Diimide wordt op twee manieren verkregen: de oxidatie van hydrazine met waterstofperoxide in aanwezigheid van Cu2+-ionen of de reactie van hydrazine met Ni-Raney (hydrazinedehydrogenering). Als er een alkeen in het reactiemengsel aanwezig is, wordt de dubbele binding ervan gehydrogeneerd door het zeer onstabiele diimide. Een onderscheidend kenmerk van deze methode is de strikte syn-stereospecificiteit van het restauratieproces. Er wordt aangenomen dat deze reactie verloopt via een cyclisch geactiveerd complex met een strikte oriëntatie van beide reagerende moleculen in de ruimte.

4.3. Elektrofiele additiereacties aan de dubbele binding van alkenen
De grens-HOMO- en LUMO-orbitalen van alkenen zijn de bezette en lege * orbitalen. Bijgevolg zal de -orbitaal deelnemen aan reacties met elektrofielen (E +), en zal de *-orbitaal van de C=C-binding deelnemen aan reacties met nucleofielen (Nu -) (zie figuur 3). In de meeste gevallen reageren eenvoudige alkenen gemakkelijk met elektrofielen, maar met grote moeite met nucleofielen. Dit wordt verklaard door het feit dat de LUMO van de meeste elektrofielen gewoonlijk qua energie dicht bij de energie van de -HOMO van alkenen ligt, terwijl de HOMO van de meeste nucleofielen aanzienlijk lager ligt dan de *-LUMO.

Eenvoudige alkenen reageren alleen onder zware omstandigheden met zeer sterke nucleofiele middelen (carbanionen). De introductie van elektronenzuigende groepen in alkenen, bijvoorbeeld NO2, COR, enz., leidt echter tot een verlaging van het *-niveau, als gevolg van waarbij het alkeen het vermogen verkrijgt om te reageren met nucleofielen van gemiddelde sterkte (ammoniak, RO - , Nє C - , enolaatanion, enz.).
Als gevolg van de interactie van het elektrofiele middel E+ met een alkeen wordt een carbokation gevormd, dat zeer reactief is. De carbokation wordt verder gestabiliseerd door de snelle toevoeging van het nucleofiele middel Nu - :


Omdat de langzame fase de toevoeging van een elektrofiel is, moet het proces van toevoeging van elk polair middel E + Nu precies worden beschouwd als een elektrofiele toevoeging aan de meervoudige binding van een alkeen. Er is een groot aantal reacties van dit type bekend, waarbij de rol van het elektrofiele middel wordt gespeeld door halogenen, waterstofhalogeniden, water, tweewaardige kwikzouten en andere polaire reagentia. Elektrofiele toevoeging aan een dubbele binding bij de classificatie van organische reactiemechanismen heeft het symbool Ad E ( Toevoeging Elektrofiel) en wordt, afhankelijk van het aantal reagerende moleculen, aangeduid als Ad E 2 (bimoleculaire reactie) of Ad E 3 (trimoleculaire reactie).
4.3.a. Toevoeging van halogenen
Alkenen reageren met broom en chloor en vormen additieproducten aan de dubbele binding van één halogeenmolecuul met een opbrengst die bijna kwantitatief is. Fluor is te actief en veroorzaakt de vernietiging van alkenen. De toevoeging van jodium aan alkenen is in de meeste gevallen een omkeerbare reactie, waarvan het evenwicht wordt verschoven naar de oorspronkelijke reagentia.



De snelle ontkleuring van een oplossing van broom in CCl4 dient als een van de eenvoudigste tests voor onverzadiging, aangezien alkenen, alkynen en dienen snel reageren met broom.
De toevoeging van broom en chloor aan alkenen vindt plaats via een ionisch in plaats van een radicaalmechanisme. Deze conclusie volgt uit het feit dat de snelheid waarmee halogeen wordt toegevoegd niet afhankelijk is van bestraling, de aanwezigheid van zuurstof en andere reagentia die radicaalprocessen initiëren of remmen. Op basis van een groot aantal experimentele gegevens werd een mechanisme voor deze reactie voorgesteld, inclusief verschillende opeenvolgende fasen. In de eerste fase vindt polarisatie van het halogeenmolecuul plaats onder invloed van bindende elektronen. Het halogeenatoom, dat een bepaalde fractionele positieve lading verkrijgt, vormt een onstabiel tussenproduct met de elektronen van de -binding, een zogenaamde -complex of een ladingsoverdrachtscomplex. Opgemerkt moet worden dat het halogeen in het -complex geen gerichte binding vormt met een specifiek koolstofatoom; In dit complex wordt de donor-acceptor-interactie van een elektronenpaar - binding als donor en een halogeen als acceptor eenvoudig gerealiseerd.

Vervolgens transformeert het -complex in een cyclisch bromoniumion. Tijdens de vorming van dit cyclische kation vindt heterolytische splitsing van de Br-Br-binding plaats en ontstaat er een lege R-de sp 2 orbitaal van het gehybridiseerde koolstofatoom overlapt met R-orbitaal van het “eenzame paar” elektronen van het halogeenatoom, waardoor een cyclisch bromoniumion wordt gevormd.

In de laatste, derde fase valt het broomanion, als nucleofiel agens, een van de koolstofatomen van het broomion aan. Nucleofiele aanval door het bromide-ion leidt tot de opening van de drieledige ring en de vorming van een vicinaal dibromide ( Vic-in de buurt van). Deze stap kan formeel worden beschouwd als een nucleofiele substitutie van SN2 aan het koolstofatoom, waarbij de vertrekkende groep Br+ is.

De toevoeging van halogenen aan de dubbele binding van alkenen is een van de formeel eenvoudige modelreacties, aan de hand van het voorbeeld waarvan men de invloed kan beschouwen van de belangrijkste factoren die het mogelijk maken om beredeneerde conclusies te trekken over het gedetailleerde mechanisme van het proces. Om weloverwogen conclusies te kunnen trekken over het mechanisme van welke reactie dan ook, moet u over gegevens beschikken over: 1) reactiekinetiek; 2) stereochemie (stereochemisch resultaat van de reactie); 3) de aanwezigheid of afwezigheid van een daarmee samenhangend, concurrerend proces; 4) de invloed van substituenten in het oorspronkelijke substraat op de reactiesnelheid; 5) gebruik van gelabelde substraten en (of) reagentia; 6) de mogelijkheid van herschikkingen tijdens de reactie; 7) het effect van het oplosmiddel op de reactiesnelheid.
Laten we deze factoren bekijken aan de hand van het voorbeeld van de halogenering van alkenen. Kinetische gegevens maken het mogelijk om voor elke component de volgorde van de reactie vast te stellen en op basis hiervan een conclusie te trekken over de algehele moleculaire aard van de reactie, dat wil zeggen het aantal reagerende moleculen.
Voor de bromering van alkenen wordt de reactiesnelheid doorgaans beschreven door de volgende vergelijking:
v = k`[alkeen] + k``[alkeen] 2,
wat in zeldzame gevallen vereenvoudigd wordt
v = k`[alkeen].
Op basis van de kinetische gegevens kan worden geconcludeerd dat één of twee broommoleculen betrokken zijn bij de snelheidsbepalende stap. De tweede orde in broom betekent dat het niet het bromide-ion Br is dat reageert met het bromoniumion, maar het tribromide-ion dat wordt gevormd door de interactie van broom en bromide-ion:
![]()
Dit evenwicht is naar rechts verschoven. Kinetische gegevens laten ons niet toe om andere conclusies te trekken over de structuur van de overgangstoestand en de aard van de elektrofiele soort in de reactie van halogeentoevoeging aan de dubbele binding. De meest waardevolle informatie over het mechanisme van deze reactie wordt geleverd door gegevens over de stereochemie van de toevoeging. De toevoeging van een halogeen aan een dubbele binding is een stereospecifiek proces (een proces waarbij slechts één van de mogelijke stereo-isomeren wordt gevormd; bij een stereoselectief proces wordt de preferentiële vorming van één stereomeer waargenomen) anti-toevoegingen voor alkenen en cycloalkenen waarbij de dubbele binding niet aan de benzeenring is geconjugeerd. Voor cis- En trance-isomeren van buteen-2, penteen-2, hexeen-3, cyclohexeen, cyclopenteen en andere alkenen, de toevoeging van broom vindt uitsluitend plaats als anti- toetreding. In dit geval alleen in het geval van cyclohexeen trance-1,2-dibroomcyclohexaan (mengsel van enantiomeren).

De trans-rangschikking van broomatomen in 1,2-dibroomcyclohexaan kan vereenvoudigd worden weergegeven ten opzichte van het gemiddelde vlak van de cyclohexaanring (zonder rekening te houden met conformaties):
Wanneer broom zich verbindt met cyclohexeen, ontstaat het aanvankelijk trance-1,2-dibroomcyclohexaan in een, een-conformatie, die dan onmiddellijk verandert in een energetisch gunstiger haar- conformatie. Anti-de toevoeging van halogenen aan een dubbele binding stelt ons in staat het mechanisme van eenstaps synchrone toevoeging van één halogeenmolecuul aan een dubbele binding te verwerpen, wat alleen kan gebeuren als syn- toetreding. Anti-toevoeging van een halogeen is ook niet consistent met de vorming van een open carbokation RCH + -CH2Hal als tussenproduct. Bij een open carbokation is vrije rotatie rond de C-C-binding mogelijk, wat zou moeten leiden tot de aanval van het branion - tot de vorming van een mengsel van producten als anti- en dus syn- toetredingen. Stereospecifiek anti-de toevoeging van halogenen was belangrijkste reden het creëren van het concept van bromonium- of chloroniumionen als afzonderlijke tussensoorten. Dit concept voldoet perfect aan de regel anti-toevoeging, aangezien een nucleofiele aanval van het halogenide-ion mogelijk is anti-zijden aan een van de twee koolstofatomen van het halogenide-ion via het SN 2-mechanisme.

In het geval van asymmetrisch gesubstitueerde alkenen zou dit moeten resulteren in twee enantiomeren trio-vorm bij toevoeging van broom aan cis-isomeer of enantiomeer erytro-vormt bij halogenering trance-isomeer. Dit wordt feitelijk waargenomen wanneer broom wordt toegevoegd aan bijvoorbeeld cis- En trance-isomeren van penteen-2.




In het geval van bromering van symmetrische alkenen bijvoorbeeld cis- of trance-hexeen-3 moet worden gevormd of een racemaat ( D, L-formulier), of meso-vorm van het uiteindelijke dibromide, wat feitelijk wordt waargenomen.




Er is onafhankelijk, direct bewijs voor het bestaan van halogeniumionen in een niet-nucleofiele, onverschillige omgeving bij lage temperatuur. Met behulp van NMR-spectroscopie werd de vorming van broomionen geregistreerd tijdens de ionisatie van 3-broom-2-methyl-2-fluorbutaan onder invloed van een zeer sterk Lewis-zuur van antimoonpentafluoride in een oplossing van vloeibaar zwaveldioxide bij -80 ° C. .

Dit kation is tamelijk stabiel bij -80°C in een niet-nucleofiele omgeving, maar wordt onmiddellijk vernietigd door de werking van nucleofiele middelen of door verhitting.
Cyclische bromoniumionen kunnen soms in zuivere vorm worden geïsoleerd als sterische obstakels hun opening onder invloed van nucleofielen verhinderen:

Het is duidelijk dat de mogelijkheid van het bestaan van bromoniumionen, die onder speciale omstandigheden vrij stabiel zijn, niet kan dienen als direct bewijs van hun vorming in de reactie van broomadditie aan de dubbele binding van een alkeen in alcohol, azijnzuur en andere elektronen. -het doneren van oplosmiddelen. Dergelijke gegevens moeten alleen worden beschouwd als een onafhankelijke bevestiging van de fundamentele mogelijkheid van de vorming van halogeniumionen tijdens het proces van elektrofiele additie aan de dubbele binding.
Het concept van het halogenide-ion stelt ons in staat een rationele verklaring te geven voor de omkeerbaarheid van de toevoeging van jodium aan de dubbele binding. Het halogeniumkation heeft drie elektrofiele centra die toegankelijk zijn voor nucleofiele aanvallen door het halogenide-anion: twee koolstofatomen en een halogeenatoom. In het geval van chloroniumionen lijkt het C-anion bij voorkeur of zelfs uitsluitend de koolstofcentra van het kation aan te vallen. Voor het bromoniumkation zijn beide openingsrichtingen van het halogeniumion even waarschijnlijk, zowel als gevolg van de aanval van het bromide-ion op zowel koolstofatomen als op het broomatoom. Nucleofiele aanval op het broomatoom van het bromoniumion leidt tot de uitgangsreagentia broom en alkeen:

Het jodoniumion wordt voornamelijk onthuld als gevolg van de aanval van het jodide-ion op het jodiumatoom, en daarom wordt het evenwicht tussen de uitgangsreagentia en het jodoniumion naar links verschoven.

Daarnaast, eindproduct bovendien - het vicinale dijodide kan een nucleofiele aanval op het jodiumatoom ondergaan door het trijodide-anion dat in de oplossing aanwezig is, wat ook leidt tot de vorming van de initiële reagentia alkeen en jodium. Met andere woorden, onder de omstandigheden van de additiereactie wordt het resulterende vicinale dijodide gedejodeerd onder de werking van het trijodide-anion. Vicinale dichloriden en dibromiden dehalogeneren niet onder de omstandigheden van de toevoeging van respectievelijk chloor of broom aan alkenen.
Anti-additie van chloor of broom is kenmerkend voor alkenen, waarbij de dubbele binding niet geconjugeerd is met de -elektronen van de benzeenring. Voor styreen, stilbeen en hun derivaten samen met anti- toetreding plaatsvindt en syn-toevoeging van een halogeen, dat zelfs dominant kan worden in een polaire omgeving.


In gevallen waarin de toevoeging van een halogeen aan een dubbele binding wordt uitgevoerd in een nucleofiele oplosmiddelomgeving, concurreert het oplosmiddel effectief met het halogenide-ion bij het openen van de drieledige ring van het halogeniumion:

De vorming van additieproducten met de deelname van een oplosmiddel of een ander "extern" nucleofiel agens wordt een conjugaatadditiereactie genoemd. Wanneer broom en styreen reageren in methanol, worden twee producten gevormd: vicinaal dibromide en broomester, waarvan de verhouding afhangt van de concentratie broom in methanol.
In een sterk verdunde oplossing domineert het conjugaatadditieproduct, terwijl in een geconcentreerde oplossing daarentegen vicinaal dibromide de overhand heeft. In een waterige oplossing overheerst altijd halohydrine (een alcohol die een halogeen bevat aan het -koolstofatoom) - het product van conjugaatadditie.

haar-conform trance-2-chloorcyclohexanol wordt verder gestabiliseerd door een O-H-waterstofbinding . . . Kl. In het geval van asymmetrische alkenen voegt het halogeen bij geconjugeerde additiereacties altijd toe aan het koolstofatoom dat het grootste aantal waterstofatomen bevat, en het nucleofiele agens aan de koolstof met het minste aantal waterstofatomen. Er wordt geen isomeer product met een andere rangschikking van verbindende groepen gevormd. Dit betekent dat het als tussenproduct gevormde cyclische halogenoniumion een asymmetrische structuur moet hebben met twee bindingen C 1 -Hal en C 2 -Hal die verschillen in energie en sterkte en een grote positieve lading op het interne koolstofatoom C 2, die kan zijn grafisch uitgedrukt op twee manieren:

Daarom is het C2-koolstofatoom van het halogeniumion onderhevig aan nucleofiele aanval door het oplosmiddel, ondanks het feit dat het meer gesubstitueerd en sterisch minder toegankelijk is.


Een van de beste voorbereidingsmethoden voor de synthese van broomhydrinen is de hydroxybromering van alkenen met behulp van N-broomsuccinimide ( N.B.S.) in een binair mengsel van dimethylsulfoxide ( DMSO) en water.

Deze reactie kan met of zonder water worden uitgevoerd DMSO de opbrengsten aan broomhydrinen zijn in dit geval echter iets lager.



De vorming van geconjugeerde additieproducten in de halogeneringsreactie van alkenen maakt het ons ook mogelijk om het synchrone mechanisme van additie van één halogeenmolecuul te verwerpen. Conjugaattoevoeging aan de dubbele binding komt goed overeen met een tweestapsmechanisme waarbij het halogeniumkation als tussenproduct betrokken is.
Voor de reactie van elektrofiele additie aan een dubbele binding mag men een toename van de reactiesnelheid verwachten in de aanwezigheid van elektronendonerende alkylsubstituenten en een afname in de aanwezigheid van elektronenzuigende substituenten aan de dubbele binding. De snelheid waarmee chloor en broom aan de dubbele binding worden toegevoegd, neemt inderdaad scherp toe wanneer van ethyleen naar zijn methyl-gesubstitueerde derivaten wordt overgegaan. De snelheid waarmee broom aan tetramethylethyleen wordt toegevoegd, is bijvoorbeeld 10-5 keer hoger dan de snelheid waarmee broom aan 1-buteen wordt toegevoegd. Deze enorme versnelling duidt duidelijk op de hoge polariteit van de overgangstoestand en de hoge mate van ladingsscheiding in de overgangstoestand en is consistent met het eletrofiele optellingsmechanisme.
In sommige gevallen gaat de toevoeging van chloor aan alkenen die elektronendonerende substituenten bevatten gepaard met de abstractie van een proton uit de tussenverbinding in plaats van de toevoeging van een chloride-ion. De abstractie van een proton resulteert in de vorming van een chloor-gesubstitueerd alkeen, dat formeel kan worden beschouwd als een directe substitutie met migratie van dubbele bindingen. Experimenten met isotopische tracers duiden echter op een complexere aard van de transformaties die hier plaatsvinden. Wanneer isobutyleen bij 0 ° C wordt gechloreerd, wordt 2-methyl-3-chloorpropeen (metallylchloride) gevormd in plaats van het verwachte dichloride, het product van de additie aan de dubbele binding.

Formeel lijkt het erop dat er sprake is van vervanging en niet van toetreding. Het onderzoek van deze reactie met behulp van isobutyleen gelabeld op positie 1 met de 14C-isotoop toonde aan dat directe vervanging van waterstof door chloor niet plaatsvindt, omdat in het resulterende metallylchloride het label zich in de 14CH2Cl-groep bevindt. Dit resultaat kan worden verklaard door de volgende reeks transformaties:

In sommige gevallen kan ook 1,2-migratie van de alkylgroep optreden

In CCl4 (niet-polair oplosmiddel) levert deze reactie bijna 100% dichloride op B- product van gewone additie bij een dubbele binding (zonder herschikking).
Dit soort skeletherschikkingen zijn het meest typerend voor processen waarbij open carbokaties als tussendeeltjes betrokken zijn. Het is mogelijk dat de toevoeging van chloor in deze gevallen niet via het chloroniumion plaatsvindt, maar via een kationisch deeltje dichtbij het open carbokation. Tegelijkertijd moet worden opgemerkt dat skeletherschikkingen een vrij zeldzaam fenomeen zijn bij de processen van toevoeging van halogenen en gemengde halogenen aan de dubbele binding: ze worden vaker waargenomen tijdens de toevoeging van chloor en veel minder vaak tijdens de toevoeging van chloor. broom. De waarschijnlijkheid van dergelijke herschikkingen neemt toe bij de overgang van niet-polaire oplosmiddelen (CCl 4) naar polaire oplosmiddelen (nitromethaan, acetonitril).
Als we de gepresenteerde gegevens over stereochemie, conjugaatadditie, de invloed van substituenten in het alkeen, evenals herschikkingen in de additiereacties van halogenen aan de dubbele binding samenvatten, moet worden opgemerkt dat ze goed overeenkomen met het mechanisme van elektrofiele additie waarbij het cyclische halogeniumion. Gegevens over de toevoeging van gemengde halogenen aan alkenen, waarbij de additiestadia worden bepaald door de polariteit van de binding van twee halogeenatomen, kunnen op dezelfde manier worden geïnterpreteerd.
ALKENES
Koolwaterstoffen, in het molecuul waarvan er naast eenvoudige koolstof-koolstof en koolstof-waterstof σ-bindingen ook koolstof-koolstof π-bindingen zijn, worden genoemd onbeperkt. Omdat de vorming van een π-binding formeel equivalent is aan het verlies van twee waterstofatomen door het molecuul, bevatten onverzadigde koolwaterstoffen 2p er zijn minder waterstofatomen dan de beperkende atomen, waar P - aantal π-bindingen:
Een reeks waarvan de leden met (2H) n van elkaar verschillen, wordt genoemd isologische reeksen. In het bovenstaande schema zijn de isologen dus hexanen, hexenen, hexadiënen, hexines, hexatriënen, enz.
Koolwaterstoffen die één π-binding bevatten (d.w.z. dubbele binding) worden genoemd alkenen (olefinen) of, volgens het eerste lid van de reeks - ethyleen, ethyleenkoolwaterstoffen. Hun algemene formule homologe reeks S p N 2l.
1. Nomenclatuur
In overeenstemming met de IUPAC-regels krijgt bij het construeren van de namen van alkenen de langste koolstofketen die een dubbele binding bevat de naam van het overeenkomstige alkaan waarvan het einde -een vervangen door -nl. Deze keten is zo genummerd dat de koolstofatomen die betrokken zijn bij de vorming van de dubbele binding de laagst mogelijke nummers krijgen:

Radicalen worden genoemd en genummerd zoals in het geval van alkanen.
Voor alkenen met een relatief eenvoudige structuur zijn eenvoudiger namen toegestaan. Enkele van de meest voorkomende alkenen worden dus genoemd door het achtervoegsel toe te voegen -nl naar de naam van een koolwaterstofradicaal met hetzelfde koolstofskelet:
Koolwaterstofradicalen gevormd uit alkenen krijgen het achtervoegsel -enil. De nummering in het radicaal begint met het koolstofatoom met een vrije valentie. Voor de eenvoudigste alkenylradicalen is het echter toegestaan om in plaats van systematische namen triviale namen te gebruiken:

Waterstofatomen die direct gebonden zijn aan onverzadigde koolstofatomen en een dubbele binding vormen, worden vaak genoemd vinylwaterstofatomen,
2. Isomerie
Naast isomerie van het koolstofskelet komt ook isomerie van de positie van de dubbele binding voor in de reeks alkenen. Over het algemeen is dit type isomerie dat wel isomerie van substituentpositie (functie)- waargenomen in alle gevallen waarin het molecuul functionele groepen bevat. Voor het C4H10-alkaan zijn twee structurele isomeren mogelijk:
Voor het C4H8-alkeen (buteen) zijn drie isomeren mogelijk:

Buteen-1 en buteen-2 zijn isomeren van de positie van de functie (in dit geval wordt de rol ervan gespeeld door een dubbele binding).
Ruimtelijke isomeren verschillen in de ruimtelijke rangschikking van substituenten ten opzichte van elkaar en worden genoemd cis-isomeren, als de substituenten zich aan dezelfde kant van de dubbele binding bevinden, en trans-isomeren, indien aan weerszijden:

3. Structuur van een dubbele binding
De splitsingsenergie van een molecuul bij de dubbele C=C-binding is 611 kJ/mol; aangezien de energie van de C-C σ-binding 339 kJ/mol is, is de energie voor het verbreken van de π-binding slechts 611-339 = 272 kJ/mol. π -elektronen zijn veel lichter dan σ -elektronen en zijn gevoelig voor de invloed van bijvoorbeeld polariserende oplosmiddelen of de invloed van aanvallende reagentia. Dit wordt verklaard door het verschil in de symmetrie van de verdeling van de elektronenwolk van σ- en π-elektronen. De maximale overlap van p-orbitalen en bijgevolg de minimale vrije energie van het molecuul worden alleen gerealiseerd met een vlakke structuur van het vinylfragment en met een verkorte afstand N-N, gelijk aan 0,134 nm, d.w.z. aanzienlijk kleiner dan de afstand tussen koolstofatomen verbonden door een enkele binding (0,154 nm). Naarmate de ‘helften’ van het molecuul ten opzichte van elkaar roteren langs de as van de dubbele binding, neemt de mate van orbitale overlap af, wat verband houdt met het energieverbruik. Het gevolg hiervan is de afwezigheid van vrije rotatie langs de as van de dubbele binding en het bestaan van geometrische isomeren met geschikte substitutie aan de koolstofatomen.
Net als alkanen zijn de lagere homologen van een aantal van de eenvoudigste alkenen onder normale omstandigheden gassen, en vanaf C 5 zijn het laagkokende vloeistoffen.

Alle alkenen zijn, net als alkanen, vrijwel onoplosbaar in water en zeer oplosbaar in andere organische oplosmiddelen, met uitzondering van methylalcohol; ze hebben allemaal een lagere dichtheid dan water.
5. Chemische eigenschappen
Bij het overwegen van de reactiviteit van complexe organische verbindingen is het volgende van toepassing: algemeen principe. Bij de meeste reacties is het niet de ‘inerte’ koolwaterstofradicaal die meedoet, maar de bestaande functionele groepen en hun directe omgeving. Dit is normaal, omdat de meeste verbindingen minder sterk zijn dan S-S-verbindingen en C-H, en bovendien zijn de bindingen in en nabij de functionele groep het meest gepolariseerd.
Het is normaal om te verwachten dat de reacties van alkenen zullen plaatsvinden via een dubbele binding, die ook als een functionele groep kan worden beschouwd, en daarom additiereacties zullen zijn, en geen substitutiereacties die kenmerkend zijn voor de eerder besproken alkanen.
Waterstof toevoeging
De toevoeging van waterstof aan alkenen leidt tot de vorming van alkanen:
De toevoeging van waterstof aan ethyleenverbindingen in afwezigheid van katalysatoren vindt alleen plaats bij hoge temperaturen, waarbij vaak de afbraak van organische stoffen begint. De toevoeging van waterstof gebeurt veel gemakkelijker in aanwezigheid van katalysatoren. De katalysatoren zijn metalen uit de platinagroep in een fijn gedispergeerde toestand, platina zelf en vooral palladium - al bij normale temperaturen. De ontdekking van Sabatier, die speciaal bereid fijngemalen nikkel gebruikte bij een temperatuur van 150-300°C en in talrijke werken de veelzijdigheid van deze katalysator voor een aantal reductiereacties aantoonde, was van groot praktisch belang.
Toevoeging van halogenen
Halogenen voegen zich toe aan alkenen om dihalogeenderivaten te vormen die halogeenatomen bevatten op aangrenzende koolstofatomen:

In de eerste fase van deze reactie vindt interactie plaats tussen de π-elektronen van de dubbele binding en de elektrofiele halogeensoort om het π-complex (I) te vormen. Vervolgens wordt het π-complex herschikt tot onium(bromonium)-ion (II) onder eliminatie van het halogeenanion, dat in evenwicht is met het carbokation (III). Het anion valt vervolgens het oniumion aan en vormt het additieproduct (IV):

Anionaanval van het bromoniumion (II) om dibromide (IV) te vormen vindt plaats in de trans-positie. In het geval van toevoeging van Br2 aan cyclopenteen wordt dus alleen trans-1,2-dibroomdiclopentaan gevormd:

Bewijs voor de tweetraps toevoeging van halogeen aan alkenen is het feit dat wanneer Br2 wordt toegevoegd aan cyclohexeen in aanwezigheid van NaCl, niet alleen trans-1,2-dibroomcyclohexaan, maar ook trans-1-broom-2-chloorcyclohexaan wordt toegevoegd. gevormd:

Radicale halogenering
Onder zware omstandigheden (gasfase, 500°C) voegen halogenen zich niet toe aan de dubbele binding, maar vindt halogenering van de α-positie plaats:
In dit geval volgt de reactie een radicaalmechanisme.
Toevoeging van waterstofhalogeniden
Waterstofhalogeniden voegen zich toe aan alkenen om alkylhalogeniden te vormen. In het geval van asymmetrische moleculen volgt de toevoeging de regel van Markovnikov, dat wil zeggen dat waterstof zich hecht aan het meest gehydrogeneerde koolstofatoom (met het grootste aantal waterstofatomen):
Deze reactie vindt, net als de toevoeging van broom aan ethyleen, plaats na de vorming van het π-complex via het stadium van vorming van het protoniumion:

In aanwezigheid van peroxiden voegt waterstofbromide niet toe volgens de regel van Markovnikov (Kharash-effect):
In aanwezigheid van peroxiden verloopt de reactie niet via het mechanisme van elektrofiele additie, zoals hierboven, maar via een radicaalmechanisme. De eerste fase is de aanval van het peroxideradicaal op het HBr-molecuul:
Het resulterende broomradicaal voegt zich bij propyleen en vormt een nieuw radicaal:

Dit laatste wordt gestabiliseerd door de verdrijving van waterstof uit een nieuw HBr-molecuul met de regeneratie van een nieuw broomradicaal, enz.:
En in dit geval wordt de richting van het proces bepaald door de stabiliteit van broompropaanradicalen: er wordt voornamelijk de stabielere gevormd, wat leidt tot 1-broompropaan.
Toevoeging van water en zwavelzuur
In aanwezigheid van zuren voegt water toe aan de dubbele binding volgens de regel van Markovnikov:
Dezelfde reactie vindt plaats met zwavelzuur:
Oxidatie met kaliumpermanganaat in een neutraal of licht alkalisch milieu (Wagner-reactie)
In de eerste fase wordt, volgens het cis-additiemechanisme, het MnO 4 -ion toegevoegd aan de meervoudige binding, gevolgd door hydrolytische splitsing van het onstabiele additieproduct en de afgifte van het MnO 3 - ion.

De reactie volgt het cis-additieschema:

Zure permanganaatoplossingen oxideren alkenen met ketensplitsing bij de C = C-binding en de vorming van zuren of ketonen:
Effect van ozon op alkenen
Deze reactie leidt tot kristallijne, zeer explosieve ozoniden, die bij hydrolyse aldehyden of ketonen vormen:

De reactie wordt vaak gebruikt om de positie van de dubbele binding in een molecuul te bepalen, omdat de structuur van het oorspronkelijke alkeen kan worden afgeleid uit de gevormde carbonylverbindingen.
De reactie verloopt via cis-cycloadditie door het stadium van onstabiel molozonide, dat dissociatie en daaropvolgende recombinatie ondergaat:

Polymerisatie van alkenen
Van bijzonder belang is de polymerisatie van ethyleen en propyleen tot polymeren met een molecuulgewicht van ongeveer 10 5. Tot 1953 werd voornamelijk radicaalpolymerisatie (door vrije radicalen geïnitieerd) toegepast, hoewel in principe zowel anionische als kationische initiatie van het proces werd toegepast.
Na het werk van Ziegler en Nutt, die voor deze studies de Nobelprijs ontvingen, ontstonden de zogenaamde coördinatie polymerisatie. De eenvoudigste “Ziegler”-katalysator van dit type bestaat uit triethylaluminium- en titanium (IV) verbindingen. In dit geval worden polymeren gevormd hoge graad stereoregelmatigheid. Bij het polymeriseren van propyleen wordt bijvoorbeeld isotactisch polypropyleen gevormd - een polymeer waarin alle zij-CH 3-groepen dezelfde ruimtelijke positie innemen:

Hierdoor krijgt het polymeer een grotere sterkte en kan het zelfs worden gebruikt om synthetische vezels te maken.
Polyethyleen verkregen via deze methode is een verzadigde koolwaterstof met een rechte keten. Het is minder elastisch dan hogedrukpolyethyleen, maar heeft een grotere hardheid en is bestand tegen hogere temperaturen.
Door de combinatie van vele waardevolle eigenschappen heeft polyethyleen een zeer breed toepassingsgebied. Het is een van de beste materialen voor kabelisolatie, voor gebruik in radartechnologie, radiotechniek, landbouw, enz. Er worden buizen, slangen, vaten, containers voor landbouwproducten en meststoffen, films van verschillende diktes en veel huishoudelijke artikelen van gemaakt. Duurzame polyethyleenfilms worden zelfs gebruikt als coating voor de bodem van kunstmatige kanalen om ze waterdicht te maken.
Telomerisatie
Een interessant industrieel gebruikt proces is de copolymerisatie van ethyleen met tetrachloorkoolstof, genaamd telomerisatie. Als benzoylperoxide of een andere initiator die ontleedt en vrije radicalen vormt, wordt toegevoegd aan een mengsel van ethyleen en CC14, vindt het volgende proces plaats:
CC1 3" radicalen initiëren ketenpolymerisatie van ethyleen:
Wanneer het een ander CC1 4-molecuul tegenkomt, stopt de ketengroei:
Radicale CC1 3 - geeft aanleiding tot een nieuwe keten.
De resulterende polymerisatieproducten met een laag molecuulgewicht die halogeenatomen aan de uiteinden van de keten bevatten, worden genoemd telomeren. Telomeren met verkregen waarden n =2,3, 4, ...,15.
De hydrolyse van telomerisatieproducten levert ω-chloor-gesubstitueerde carbonzuren op, wat waardevolle chemische producten zijn.
Algemene formule van alkenen: CnH2n(n 2)
De eerste vertegenwoordigers van de homologe reeks alkenen:

De formules van alkenen kunnen worden samengesteld uit de overeenkomstige formules van alkanen (verzadigde koolwaterstoffen). De namen van alkenen worden gevormd door het achtervoegsel -aan van het overeenkomstige alkaan te vervangen door -een of –yleen: butaan - butyleen, pentaan - penteen, enz. Het nummer van het koolstofatoom met een dubbele binding wordt aangegeven door een Arabisch cijfer achter de naam.
De koolstofatomen die betrokken zijn bij de vorming van de dubbele binding bevinden zich in een staat van sp-hybridisatie. Drie bindingen gevormd door hybride orbitalen en bevinden zich in hetzelfde vlak onder een hoek van 120° ten opzichte van elkaar. Een extra binding wordt gevormd door laterale overlap van niet-hybride p-orbitalen:

De lengte van de dubbele C=C-binding (0,133 nm) is korter dan de lengte van de enkele binding (0,154 nm). De energie van een dubbele binding is minder dan tweemaal de energie van een enkele binding, omdat de energie van de -binding kleiner is dan de energie van de -binding.
Alkeen-isomeren
Alle alkenen behalve ethyleen hebben isomeren. Alkenen worden gekenmerkt door isomerie van het koolstofskelet, isomerie van de positie van de dubbele binding, interklasse- en ruimtelijke isomerie.
Het interklasse-isomeer van propeen (C 3 H 6) is cyclopropaan. Beginnend met buteen (C 4 H 8), blijkt isomerie uit de positie van de dubbele binding (buteen-1 en buteen-2), isomerie van het koolstofskelet (methylpropeen of isobuteen), evenals ruimtelijke isomerie (cis-buteen- 2 en trans-buteen-2). Bij cis-isomeren bevinden de substituenten zich aan één kant, en bij trans-isomeren bevinden ze zich aan weerszijden van de dubbele binding.
De chemische eigenschappen en chemische activiteit van alkenen worden bepaald door de aanwezigheid van een dubbele binding in hun moleculen. De meest voorkomende reacties voor alkenen zijn elektrofiele additie: hydrohalogenering, hydratatie, halogenering, hydrogenering, polymerisatie.
Kwalitatieve reactie op een dubbele binding – verkleuring van broomwater:
Voorbeelden van het oplossen van problemen met het onderwerp "formule van alkenen"
VOORBEELD 1
| Oefening | Hoeveel isomeren die broomwater kunnen ontkleuren heeft een stof met de samenstelling C 3 H 5 Cl? Schrijven structuurformules deze isomeren |
| Oplossing | C 3 H 5 Cl is een monochloorderivaat van de koolwaterstof C 3 H 6 . Deze formule komt overeen met propeen, een koolwaterstof met één dubbele binding, of met cyclopropaan (een cyclische koolwaterstof). Deze stof verkleurt broomwater, waardoor het een dubbele binding bevat. Drie koolstofatomen kunnen alleen deze structuur vormen: aangezien isomerie van het koolstofskelet en de positie van de dubbele binding onmogelijk is met een dergelijk aantal koolstofatomen. Structurele isomerie in een bepaald molecuul is alleen mogelijk als gevolg van een verandering in de positie van het chlooratoom ten opzichte van de dubbele binding: Voor 1-chloorpropeen is cis-trans-isomerie mogelijk: |
| Antwoord | Aan de probleemvoorwaarden wordt voldaan door 4 isomeren |
VOORBEELD 2
| Oefening | Een mengsel van isomere koolwaterstoffen (gassen met een waterstofdichtheid van 21) met een volume van 11,2 liter (ns) reageerde met broomwater. Het resultaat was 40,4 g van het overeenkomstige dibroomderivaat. Welke structuur hebben deze koolwaterstoffen? Bepaal hun volumetrische inhoud in het mengsel (in%). |
| Oplossing | De algemene formule van koolwaterstoffen is C x H y. Laten we berekenen molaire massa koolwaterstoffen: Daarom is de formule van koolwaterstoffen C 3 H 6. Slechts twee stoffen hebben deze formule: propeen en cyclopropaan. Alleen propeen reageert met broomwater: Laten we de hoeveelheid dibroomderivaat berekenen: Volgens de reactievergelijking: n(propeen) mol De totale hoeveelheid koolwaterstoffen in het mengsel is gelijk aan: |