
Proprietățile fizice și chimice ale alchenelor. Formula generală a alchenelor. Proprietăți și caracteristici ale alchenelor
Alchenele sunt active chimic. Lor proprietăți chimice sunt determinate în mare măsură de prezența unei duble legături. Cele mai frecvente reacții pentru alchene sunt reacțiile de adiție electrofilă și de adiție radicalică. Reacțiile de adiție nucleofile necesită de obicei prezența unui nucleofil puternic și nu sunt tipice pentru alchene. Alchenele suferă ușor reacții de oxidare și adiție și sunt, de asemenea, capabile de substituție cu radicali alil.
Reacții de adaos
Hidrogenarea Adăugarea de hidrogen (reacție de hidrogenare) la alchene se realizează în prezența catalizatorilor. Cel mai adesea, se folosesc metale zdrobite - platină, nichel, paladiu etc. Ca urmare, se formează alcanii corespunzători (hidrocarburi saturate).
$CH_2=CH_2 + H2 → CH_3–CH_3$
Adăugarea de halogeni. Alchenele reacționează ușor, în condiții obișnuite, cu clorul și bromul pentru a forma dihaloalcanii corespunzători, în care atomii de halogen sunt localizați la atomii de carbon adiacenți.
Nota 1
Când alchenele interacționează cu bromul, bromul devine decolorat la o culoare galben-maro. Acesta este unul dintre cele mai vechi și mai simple reacții calitative la hidrocarburile nesaturate, deoarece alchinele și alcadienele reacţionează, de asemenea, în mod similar.
$CH_2=CH_2 + Br_2 → CH_2Br–CH_2Br$
Adăugarea de halogenuri de hidrogen. Când hidrocarburile de etilenă interacționează cu halogenuri de hidrogen ($HCl$, $HBr$), se formează haloalcani direcția reacției depinde de structura alchenelor.
În cazul etilenei sau alchenelor simetrice, reacția de adiție are loc fără ambiguitate și duce la formarea unui singur produs:
$CH_2=CH_2 + HBr → CH_3–CH_2Br$
În cazul alchenelor nesimetrice, este posibilă formarea a doi produși diferiți de reacție de adiție:
Nota 2
De fapt, în principal se formează un singur produs de reacție. Modelul în direcția unor astfel de reacții a fost stabilit de chimistul rus V.V. Markovnikov în 1869 Se numește regula lui Markovnikov. Când halogenurile de hidrogen interacționează cu alchene nesimetrice, se adaugă un atom de hidrogen la locul clivajului dublei legături în atomul de carbon cel mai hidrogenat, adică înainte de a fi conectat la un număr mare atomi de hidrogen.
Markovnikov a formulat această regulă pe baza datelor experimentale și abia mai târziu a primit o justificare teoretică. Luați în considerare reacția propilenei cu acid clorhidric.
Una dintre caracteristicile obligațiunii $p$ este capacitatea sa de a fi ușor polarizată. Sub influența grupării metil (efect inductiv pozitiv + $I$) din molecula de propenă, densitatea electronică a legăturii $p$ se deplasează la unul dintre atomii de carbon (= $CH_2$). Ca rezultat, apare o sarcină negativă parțială ($\delta -$). O sarcină pozitivă parțială ($\delta +$) apare pe celălalt atom de carbon al legăturii duble.
Această distribuție a densității electronilor în molecula de propilenă determină locația viitorului atac de protoni. Acesta este atomul de carbon al grupării metilen (= $CH_2$), care poartă o sarcină negativă parțială $\delta-$. Și clorul, în consecință, atacă un atom de carbon cu o sarcină pozitivă parțială $\delta+$.
În consecință, principalul produs al reacției propilenei cu acid clorhidric este 2-cloropropanul.
Hidratarea
Hidratarea alchenelor are loc în prezența acizilor minerali și se supune regulii lui Markovnikov. Produșii de reacție sunt alcooli
$CH_2=CH_2 + H_2O → CH_3–CH_2–OH$
Alchilare
Adăugarea de alcani la alchene în prezența unui catalizator acid ($HF$ sau $H_2SO_4$) la temperaturi scăzute conduce la formarea de hidrocarburi cu o greutate moleculară mai mare și este adesea folosit în industrie pentru producerea combustibilului pentru motoare
$R–CH_2=CH_2 + R’–H → R–CH_2–CH_2–R’$
Reacții de oxidare
Oxidarea alchenelor se poate produce, în funcție de condițiile și tipurile de reactivi oxidanți, atât cu clivajul dublei legături, cât și cu conservarea scheletului de carbon:
Reacții de polimerizare
Moleculele de alchenă sunt capabile să se adauge unele la altele în anumite condiții cu deschiderea legăturilor $\pi$ și formarea de dimeri, trimmeri sau compuși cu greutate moleculară mare - polimeri. Polimerizarea alchenelor poate avea loc atât prin mecanisme radicalilor liberi, cât și prin mecanisme cation-anionice. Acizii, peroxizii, metalele etc. sunt utilizați ca inițiatori de polimerizare. Reacția de polimerizare se realizează și sub influența temperaturii, iradierii și presiunii. Un exemplu tipic este polimerizarea etilenei pentru a forma polietilenă
$nCH_2=CH_2 → (–CH_2–CH_(2^–))_n$
Reacții de substituție
Reacțiile de substituție nu sunt tipice pentru alchene. Cu toate acestea, când temperaturi ridicate(peste 400 ° C) reacții de adiție radicală, care sunt reversibile și sunt suprimate. În acest caz, devine posibilă înlocuirea atomului de hidrogen situat în poziția alilic, menținând în același timp legătura dublă.
$CH_2=CH–CH_3 + Cl_2 – CH_2=CH–CH_2Cl + HCl$
Alchenele se caracterizează în primul rând prin reacții aderare printr-o legătură dublă. Practic, aceste reacții au loc printr-un mecanism ionic. Legătura pi este ruptă și se formează două noi legături sigma. Permiteți-mi să vă reamintesc că reacțiile de substituție au fost tipice pentru alcani și au urmat un mecanism radical. Moleculele de hidrogen se pot atașa la alchene; aceste reacții se numesc hidrogenare, molecule de apă, hidratare, halogenare, hidrohalogenare. Dar mai întâi lucrurile.
Reacții de adiție cu duble legătură
Aşa, primul proprietate chimică capacitatea de a adăuga halogenuri de hidrogen, hidrohalogenare.
Propena și alte alchene reacționează cu halogenurile de hidrogen conform regulii lui Markovnikov.

Un atom de hidrogen se atașează de cel mai hidrogenat, sau mai corect hidrogenat, atom de carbon.
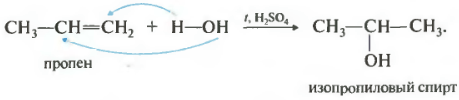
Doilea numărul de pe lista noastră de proprietăți ar fi hidratarea, adăugarea de apă.
Reacția are loc atunci când este încălzită în prezența unui acid, de obicei sulfuric sau fosforic. Adăugarea de apă are loc și în conformitate cu regula lui Markovnikov, adică alcoolul primar poate fi obținut numai prin hidratarea etilenei, restul alchenelor neramificate dau alcooli secundari.
Există excepții de la regula lui Markovnikov atât pentru hidrohalogenare, cât și pentru hidratare. În primul rând, contrar acestei reguli, adăugarea are loc în prezența peroxizilor.
În al doilea rând, pentru derivații de alchene în care sunt prezente grupări atrăgătoare de electroni. De exemplu, pentru 3,3,3-trifluorpropen-1.

Atomii de fluor, datorită electronegativității lor ridicate, atrag densitatea de electroni către ei înșiși de-a lungul unui lanț de legături sigma. Acest fenomen se numește efect inductiv negativ.

Din această cauză, electronii pi mobili ai dublei legături sunt deplasați și atomul de carbon cel mai exterior ajunge cu o sarcină pozitivă parțială, care este de obicei desemnată ca delta plus. De aici se va duce ionul de brom încărcat negativ, iar cationul de hidrogen se va atașa de atomul de carbon cel mai puțin hidrogenat.
În plus față de gruparea trifluormetil, de exemplu, gruparea triclorometil, gruparea nitro, gruparea carboxil și unele altele au un efect inductiv negativ.
Acest al doilea caz de încălcare a regulii Markovnikov în Examenul de stat unificat este foarte rar, dar este totuși recomandabil să îl țineți cont dacă intenționați să promovați examenul cu punctajul maxim.
Treilea Proprietatea chimică atașarea moleculelor de halogen.

Aceasta se referă în primul rând la brom, deoarece această reacție este calitativă pentru o legătură multiplă. Când, de exemplu, etilena este trecută prin apă cu brom, adică o soluție de brom în apă de culoare maronie, aceasta devine decolorată. Dacă treceți un amestec de gaze, de exemplu, etan și etenă, prin apă cu brom, puteți obține etan pur, fără impurități etene, deoarece va rămâne în balonul de reacție sub formă de dibrometan, care este un lichid.
De remarcat este reacția alchenelor în faza gazoasă sub încălzire puternică, de exemplu, cu clorul.
În astfel de condiții, nu are loc o reacție de adiție, ci o reacție de substituție. Mai mult, exclusiv la atomul de carbon alfa, adică atomul adiacent dublei legături. În acest caz, se obține 3-cloropropen-1. Aceste reacții sunt rare la examen, așa că majoritatea studenților nu le amintesc și, de regulă, greșesc.
Patrulea numărul este reacția de hidrogenare și odată cu ea reacția de dehidrogenare. Adică adăugarea sau îndepărtarea hidrogenului.

Hidrogenarea are loc la o temperatură nu foarte ridicată pe un catalizator de nichel. La temperaturi mai ridicate, dehidrogenarea este posibilă pentru a produce alchine.
Cincilea O proprietate a alchenelor este capacitatea de a polimeriza, atunci când sute și mii de molecule de alchenă formează lanțuri foarte lungi și puternice datorită ruperii legăturii pi și formării de legături sigma între ele.
În acest caz, rezultatul a fost polietilenă. Vă rugăm să rețineți că molecula rezultată nu conține legături multiple. Astfel de substanțe sunt numite polimeri, moleculele originale sunt numite monomeri, fragmentul care se repetă este unitatea elementară a polimerului, iar numărul n este gradul de polimerizare.
Reacții pentru a produce alte materiale polimerice importante, cum ar fi polipropilena, sunt de asemenea posibile.


Un alt polimer important este clorura de polivinil.

Materialul de pornire pentru producerea acestui polimer este cloroetena, al cărei nume comun este clorură de vinil. Deoarece acest substituent nesaturat se numește vinil. O abreviere comună pe plastic Produse din PVC reprezintă doar clorură de polivinil.
Am discutat cinci proprietăți care au reprezentat reacții de adiție a legăturii duble. Acum să ne uităm la reacții oxidare.
Reacții de oxidare a alchenei
Şaselea Proprietatea chimică din lista noastră generală este oxidarea ușoară sau reacția Wagner. Apare atunci când o alchenă este expusă la o soluție apoasă de permanganat de potasiu la rece, motiv pentru care temperatura de zero grade este adesea indicată în sarcinile de examen.
Rezultatul este alcool dihidroxilic. În acest caz, etilenglicolul, dar în general astfel de alcooli sunt nume comun glicoli În timpul reacției, soluția de permanganat violet-roz devine decolorată, deci această reacție este și calitativă pentru o legătură dublă. Manganul într-un mediu neutru este redus de la starea de oxidare +7 la starea de oxidare +4. Să ne uităm la câteva exemple suplimentare. ECUAŢIE
Aici obținem propandiol-1,2. Cu toate acestea, alchenele ciclice vor reacționa în același mod. ECUAŢIE
O altă opțiune este atunci când legătura dublă este situată, de exemplu, în lanțul lateral al hidrocarburilor aromatice. În mod regulat teme de examen Există o reacție Wagner care implică stiren, al doilea nume este vinilbenzen.

Sper că v-am oferit suficiente exemple pentru a înțelege că oxidarea ușoară a unei duble legături urmează întotdeauna o regulă destul de simplă: legătura pi este ruptă și se adaugă o grupare hidroxi la fiecare atom de carbon.
Acum, referitor la oxidarea dură. Va fi al nostru şaptelea proprietate. Această oxidare are loc atunci când o alchenă reacţionează cu o soluţie acidă de permanganat de potasiu când este încălzită.
Are loc distrugerea moleculei, adică distrugerea ei la dubla legătură. În cazul butenului-2, s-au obținut două molecule de acid acetic. În general, poziția legăturii multiple în lanțul de carbon poate fi apreciată din produsele de oxidare.
Oxidarea butenei-1 produce o moleculă de acid propionic (propanoic) și dioxid de carbon.
În cazul etilenei, obțineți două molecule de dioxid de carbon. În toate cazurile, într-un mediu acid, manganul este redus de la starea de oxidare +7 la +2.
Și în sfârșit al optulea proprietate completă oxidare sau ardere.
Alchenele ard, ca și alte hidrocarburi, până la dioxid de carbon și apă. Să scriem ecuația pentru arderea alchenelor în vedere generală.
Vor exista tot atâtea molecule de dioxid de carbon câte atomi de carbon există în molecula de alchenă, deoarece molecula de CO 2 conține un atom de carbon. Adică n molecule de CO2. Vor fi de două ori mai puține molecule de apă decât atomii de hidrogen, adică 2n/2, ceea ce înseamnă doar n.
Există același număr de atomi de oxigen în stânga și în dreapta. În dreapta sunt 2n de dioxid de carbon plus n de apă, pentru un total de 3n. În stânga există același număr de atomi de oxigen, ceea ce înseamnă că sunt de două ori mai puține molecule, deoarece molecula conține doi atomi. Adică 3n/2 molecule de oxigen. Puteți scrie 1.5n.
Am revizuit opt proprietățile chimice ale alchenelor.
4. Proprietăţile chimice ale alchenelor
Energia unei legături duble carbon-carbon în etilenă (146 kcal/mol) se dovedește a fi semnificativ mai mică decât de două ori energia unei singure legături C-C în etan (2 88 = 176 kcal/mol). Legătura -C din etilenă este mai puternică decât legătura -, prin urmare reacțiile alchenelor însoțite de scindarea legăturii - cu formarea a două noi legături simple - sunt un proces favorabil termodinamic. De exemplu, în faza gazoasă, conform datelor calculate, toate reacțiile de mai jos sunt exoterme cu o entalpie negativă semnificativă, indiferent de mecanismul lor real.
Din punctul de vedere al teoriei orbitalilor moleculari, se mai poate concluziona că legătura - este mai reactivă decât legătura -. Să luăm în considerare orbitalii moleculari ai etilenei (Fig. 2).

Într-adevăr, orbitalul de legătură al etilenei are o energie mai mare decât orbitalul de legătură, și invers, orbitalul de antilegare * al etilenei se află sub orbitalul de antilegare * al legăturii C=C. În condiții normale, orbitalii * și * ai etilenei sunt vacante. În consecință, orbitalii limită ai etilenei și ai altor alchene, care determină reactivitatea lor, vor fi -orbitali.
4.1. Hidrogenarea catalitică a alchenelor
În ciuda faptului că hidrogenarea etilenei și a altor alchene la alcani este însoțită de eliberarea de căldură, această reacție are loc la o viteză vizibilă numai în prezența anumitor catalizatori. Catalizatorul, prin definiție, nu afectează efectul termic al reacției, iar rolul său se reduce la reducerea energiei de activare. Este necesar să se facă distincția între hidrogenarea catalitică eterogenă și omogenă a alchenelor. În hidrogenarea eterogenă se folosesc catalizatori metalici fin măcinați - platină, paladiu, ruteniu, rodiu, osmiu și nichel, fie sub formă pură, fie suportați pe purtători inerți - BaSO 4, CaCO 3, cărbune activat, Al 2 O 3 etc. Toate dintre ele sunt insolubile în medii organice și acționează ca catalizatori eterogene. Cele mai active dintre ele sunt ruteniul și rodiul, dar platina și nichelul sunt cele mai răspândite. Platina este de obicei folosită sub formă de dioxid negru PtO 2, cunoscut în mod obișnuit ca catalizator Adams. Dioxidul de platină se obţine prin topirea acidului cloroplatinic H2PtCl6.


Deoarece ambii atomi de hidrogen sunt adăugați la atomii de carbon ai dublei legături de la suprafața metalului catalizator, adăugarea are loc de obicei pe o parte a dublei legături. Acest tip de conexiune se numește sin- aderare. În cazurile în care două fragmente de reactiv sunt adăugate pe părți diferite ale unei legături multiple (dublă sau triplă), anti- aderare. Termeni sin- Și anti- sunt echivalente ca înțeles cu termenii cis- Și transă-. Pentru a evita confuzia și înțelegerea greșită a termenilor sin- Și anti- faceți referire la tipul de conexiune și la termeni cis- Și transă- la structura substratului.
Legătura dublă din alchene este hidrogenată cu o viteză mai mare în comparație cu multe alte grupări funcționale (C=O, COOR, CN etc.) și, prin urmare, hidrogenarea dublei legături C=C este adesea un proces selectiv dacă hidrogenarea este efectuată. în condiții blânde(0-20 0 C și la presiunea atmosferică). Mai jos sunt câteva exemple tipice:


Inelul benzenic nu este redus în aceste condiții.
O realizare majoră și fundamental importantă în hidrogenarea catalitică este descoperirea unor complexe metalice solubile care catalizează hidrogenarea într-o soluție omogenă. Hidrogenarea eterogenă pe suprafața catalizatorilor metalici are o serie de dezavantaje semnificative, cum ar fi izomerizarea alchenelor și scindarea legăturilor unice carbon-carbon (hidrogenoliza). Hidrogenarea omogenă nu prezintă aceste dezavantaje. Pentru ultimii ani S-a obținut un grup mare de catalizatori de hidrogenare omogene - complecși de metale de tranziție care conțin diverși liganzi. Cei mai buni catalizatori pentru hidrogenarea omogenă sunt complecși de cloruri de rodiu (I) și ruteniu (III) cu trifenilfosfină - clorură de tris(trifenilfosfină)rodiu (Ph 3 P) 3 RhCl (catalizatorul lui Wilkinson) și tris(trifenilfosfină) clorhidrat de ruteniu (Ph3P) ) 3 RuHCl. Cel mai accesibil complex de rodiu se obține prin reacția clorurii de rodiu(III) cu trifenilfosfină. Complexul de rodiu al lui Wilkinson este utilizat pentru hidrogenarea dublei legături în condiții normale.

Un avantaj important al catalizatorilor omogene este capacitatea de a reduce selectiv o legătură dublă mono- sau disubstituită în prezența unei legături duble tri- și tetra-substituite datorită diferențelor mari în ratele lor de hidrogenare.

În cazul catalizatorilor omogene, adăugarea de hidrogen are loc și ca sin- aderare. Deci recuperare cis-butenă-2 cu deuteriu în aceste condiții duce la mezo-2,3-dideuterobutan.

4.2. Reducerea unei duble legături folosind diimidă
Reducerea alchenelor la alcanii corespunzători poate fi realizată cu succes folosind diimidă NH=NH.
Diimida se obține prin două metode principale: oxidarea hidrazinei cu peroxid de hidrogen în prezența ionilor de Cu 2+ sau reacția hidrazinei cu Ni-Raney (dehidrogenarea hidrazinei). Dacă o alchenă este prezentă în amestecul de reacție, legătura sa dublă este hidrogenată de diimida foarte instabilă. O caracteristică distinctivă a acestei metode este strictul sin-stereospecificitatea procesului de restaurare. Se crede că această reacție are loc printr-un complex activat ciclic cu o orientare strictă a ambelor molecule care reacţionează în spațiu.

4.3. Reacții de adiție electrofile la dubla legătură a alchenelor
Orbitii de graniță HOMO și LUMO ai alchenelor sunt orbitalii * ocupați și gol. În consecință, orbitalul - va participa la reacțiile cu electrofilii (E +), iar orbitalul * al legăturii C=C va participa la reacțiile cu nucleofilii (Nu -) (vezi Fig. 3). În cele mai multe cazuri, alchenele simple reacționează ușor cu electrofilii, dar reacționează cu mare dificultate cu nucleofilii. Acest lucru se explică prin faptul că, de obicei, LUMO al majorității electrofililor este aproape ca energie de energia -HOMO a alchenelor, în timp ce HOMO al majorității nucleofililor se află semnificativ sub *-LUMO.

Alchenele simple reacționează numai cu agenți nucleofili foarte puternici (carbanioni) în condiții dure, cu toate acestea, introducerea grupărilor atrăgătoare de electroni în alchene, de exemplu, NO 2, COR etc., duce la o scădere a nivelului *, datorită pe care alchena dobândește capacitatea de a reacționa cu nucleofili de putere medie (amoniac, RO - , Nє C - , anion enolat etc.).
Ca rezultat al interacțiunii agentului electrofil E + cu o alchenă, se formează un carbocation, care este foarte reactiv. Carbocationul este în continuare stabilizat prin adăugarea rapidă a agentului nucleofil Nu - :


Deoarece etapa lentă este adăugarea unui electrofil, procesul de adăugare a oricărui agent polar E + Nu - ar trebui considerat tocmai ca o adăugare electrofilă la legătura multiplă a unei alchene. Sunt cunoscute un număr mare de reacții de acest tip, unde rolul agentului electrofil este jucat de halogeni, halogenuri de hidrogen, apă, săruri divalente de mercur și alți reactivi polari. Adăugarea electrofilă la o legătură dublă în clasificarea mecanismelor de reacție organică are simbolul Ad E ( Adăugarea electrofilă) și, în funcție de numărul de molecule care reacţionează, este denumit Ad E 2 (reacție bimoleculară) sau Ad E 3 (reacție trimoleculară).
4.3.a. Adăugarea de halogeni
Alchenele reacţionează cu bromul şi clorul pentru a forma produşi de adiţie la dubla legătură a unei molecule de halogen cu un randament apropiat de cantitativ. Fluorul este prea activ și provoacă distrugerea alchenelor. Adăugarea de iod la alchene în cele mai multe cazuri este o reacție reversibilă, al cărei echilibru este deplasat către reactivii originali.



Decolorarea rapidă a unei soluții de brom în CCl4 servește drept unul dintre cele mai simple teste pentru nesaturare, deoarece alchenele, alchinele și dienele reacţionează rapid cu bromul.
Adăugarea de brom și clor la alchene are loc mai degrabă printr-un mecanism ionic decât radical. Această concluzie rezultă din faptul că viteza de adăugare a halogenului nu depinde de iradiere, de prezența oxigenului și de alți reactivi care inițiază sau inhibă procesele radicalice. Pe baza unui număr mare de date experimentale, a fost propus un mecanism pentru această reacție, incluzând mai multe etape secvențiale. În prima etapă, polarizarea moleculei de halogen are loc sub acțiunea electronilor de legătură. Atomul de halogen, care capătă o anumită sarcină pozitivă fracțională, formează un intermediar instabil cu electronii legăturii -, numit -complex sau complex de transfer de sarcină. Trebuie remarcat faptul că în complexul -halogenul nu formează o legătură direcționată cu niciun atom de carbon specific; În acest complex, interacțiunea donor-acceptor a unei perechi de electroni - legătura ca donor și un halogen ca acceptor este pur și simplu realizată.

Apoi, complexul - se transformă într-un ion de bromoniu ciclic. În timpul formării acestui cation ciclic, are loc clivarea heterolitică a legăturii Br-Br și un gol r-orbitalul sp 2 al atomului de carbon hibridizat se suprapune cu r-orbital „perechii singure” de electroni a atomului de halogen, formând un ion de bromoniu ciclic.

În ultima, a treia etapă, anionul brom, ca agent nucleofil, atacă unul dintre atomii de carbon ai ionului de bromoniu. Atacul nucleofil al ionului bromură duce la deschiderea inelului cu trei atomi și formarea unei dibromură vicinală ( vic-aproape). Această etapă poate fi considerată în mod formal ca o substituție nucleofilă a SN2 la atomul de carbon, unde gruparea scindabilă este Br+.

Adăugarea de halogeni la legătura dublă a alchenelor este una dintre reacțiile model simple din punct de vedere formal, folosind exemplul căruia se poate lua în considerare influența factorilor principali care permit să se tragă concluzii argumentate despre mecanismul detaliat al procesului. Pentru a trage concluzii informate despre mecanismul oricărei reacții, ar trebui să aveți date despre: 1) cinetica reacției; 2) stereochimie (rezultat stereochimic al reacției); 3) prezența sau absența unui proces asociat, concurent; 4) influența substituenților din substratul original asupra vitezei de reacție; 5) utilizarea de substraturi marcate și (sau) reactivi; 6) posibilitatea unor rearanjamente în timpul reacţiei; 7) efectul solventului asupra vitezei de reacție.
Să luăm în considerare acești factori folosind exemplul halogenării alchenelor. Datele cinetice fac posibilă stabilirea ordinii reacției pentru fiecare componentă și, pe această bază, tragerea unei concluzii despre molecularitatea globală a reacției, adică numărul de molecule care reacţionează.
Pentru bromurarea alchenelor, viteza de reacție este descrisă de obicei prin următoarea ecuație:
v = k`[alchenă] + k``[alchenă] 2,
care în cazuri rare se simplifică la
v = k`[alchenă].
Pe baza datelor cinetice, se poate concluziona că una sau două molecule de brom sunt implicate în etapa de determinare a vitezei. Al doilea ordin în brom înseamnă că nu ionul de bromur Br - cel care reacționează cu ionul de bromoniu, ci ionul de tribromur format prin interacțiunea dintre brom și ionul de bromur:
![]()
Acest echilibru este deplasat spre dreapta. Datele cinetice nu ne permit să tragem alte concluzii despre structura stării de tranziție și natura speciilor electrofile în reacția de adăugare a halogenului la legătura dublă. Cele mai valoroase informații despre mecanismul acestei reacții sunt furnizate de datele privind stereochimia adăugării. Adăugarea unui halogen la o legătură dublă este un proces stereospecific (un proces în care se formează doar unul dintre posibilii stereoizomeri; într-un proces stereoselectiv se observă formarea predominantă a unui stereomer) anti-adăugiri pentru alchene şi cicloalchene în care legătura dublă nu este conjugată la inelul benzenic. Pentru cis- Și transă-izomeri ai buten-2, pentenă-2, hexen-3, ciclohexenă, ciclopentenă și alte alchene, adăugarea de brom are loc exclusiv ca anti- aderare. În acest caz, numai în cazul ciclohexenei transă-1,2-dibromociclohexan (amestec de enantiomeri).

Aranjamentul trans al atomilor de brom din 1,2-dibromociclohexan poate fi descris într-o manieră simplificată în raport cu planul mediu al inelului ciclohexan (fără a se lua în considerare conformaţiilor):
Când bromul se combină cu ciclohexenul, se formează inițial transă-1,2-dibromociclohexan în a,a-conformatie, care apoi se transforma imediat intr-una energetic mai favorabila ei-conformaţie. Anti-adăugarea de halogeni la o legătură dublă ne permite să respingem mecanismul de adăugare sincronă într-o singură etapă a unei molecule de halogen la o legătură dublă, care poate fi realizat doar ca sin- aderare. Anti-adăugarea unui halogen este, de asemenea, incompatibilă cu formarea unui carbocation deschis RCH + -CH 2 Hal ca intermediar. Într-un carbocation deschis, este posibilă rotația liberă în jurul legăturii C-C, ceea ce ar trebui să conducă la atacul anionului Br. - la formarea unui amestec de produse ca anti- și așa sin- aderări. Stereospecific anti-adăugarea de halogeni a fost motivul principal creând conceptul ionilor de bromoniu sau cloron ca specii intermediare discrete. Acest concept îndeplinește perfect regula anti-adăugare, deoarece atacul nucleofil al ionului halogenură este posibil cu anti-laturile la oricare dintre cei doi atomi de carbon ai ionului halogenura prin mecanismul S N 2.

În cazul alchenelor substituite nesimetric, aceasta ar trebui să aibă ca rezultat doi enantiomeri trio-formă la adăugarea de brom la cis-izomer sau enantiomer eritro-se formeaza la halogenare transă-izomer. Acest lucru se observă de fapt atunci când se adaugă brom la, de exemplu, cis- Și transă-izomerii pentenei-2.




În cazul bromării alchenelor simetrice, de exemplu, cis- sau transă-hexenul-3 ar trebui să fie format sau un racemat ( D,L-form), sau mezo-forma dibromurii finale, care este ceea ce se observă de fapt.




Există dovezi independente, directe, ale existenței ionilor de halogeniu într-un mediu nenucleofil, indiferent la temperatură scăzută. Folosind spectroscopie RMN, formarea ionilor de bromoniu a fost înregistrată în timpul ionizării 3-bromo-2-metil-2-fluorobutanului sub acțiunea unui acid Lewis foarte puternic de pentafluorura de antimoniu într-o soluție de dioxid de sulf lichid la -80 0 C. .

Acest cation este destul de stabil la -80 0 C într-un mediu nenucleofil, dar este distrus instantaneu prin acțiunea oricăror agenți nucleofili sau la încălzire.
Ionii ciclici de bromoniu pot fi uneori izolați în formă pură dacă obstacolele sterice împiedică deschiderea lor sub acțiunea nucleofililor:

Este clar că posibilitatea existenței ionilor de bromoniu, care sunt destul de stabili în condiții speciale, nu poate servi ca dovadă directă a formării lor în reacția de adăugare a bromului la dubla legătură a unei alchene în alcool, acid acetic și alți electroni. -donarea de solvenți. Astfel de date ar trebui considerate doar ca o confirmare independentă a posibilității fundamentale de formare a ionilor de halogeniu în procesul de adăugare electrofilă la dubla legătură.
Conceptul de ion halogenură ne permite să oferim o explicație rațională pentru reversibilitatea adăugării iodului la legătura dublă. Cationul halogeniu are trei centri electrofili accesibili atacului nucleofil de către anionul halogenură: doi atomi de carbon și un atom de halogen. În cazul ionilor de cloron, anionul Cl - pare să atace preferenţial sau chiar exclusiv centrii de carbon ai cationului. Pentru cationul bromoniu, ambele direcții de deschidere a ionului halogeniu sunt la fel de probabile, atât datorită atacului ionului bromură asupra ambilor atomi de carbon cât și asupra atomului de brom. Atacul nucleofil asupra atomului de brom al ionului de bromoniu duce la reactivii de pornire brom și alchenă:

Ionul de iod se dezvăluie preponderent ca urmare a atacului ionului de iod asupra atomului de iod și, prin urmare, echilibrul dintre reactivii de pornire și ionul de iod este deplasat spre stânga.

In plus, produs final adiție - diiodura vicinală poate suferi atac nucleofil la atomul de iod de către anionul triiodură prezent în soluție, ceea ce duce și la formarea reactivilor inițiali alchenă și iod. Cu alte cuvinte, în condițiile reacției de adiție, diiodură vicinală rezultată este deiodată sub acțiunea anionului triiodură. Diclorurile și dibromurile vicine nu se dehalogenează în condițiile adăugării de clor sau respectiv brom la alchene.
Antiadăugarea de clor sau brom este caracteristică alchenelor, în care legătura dublă nu este conjugată cu electronii inelului benzenic. Pentru stiren, stilben și derivații acestora împreună cu anti- are loc aderarea şi sin-adăugarea unui halogen, care poate deveni chiar dominant într-un mediu polar.


În cazurile în care adăugarea unui halogen la o legătură dublă se realizează într-un mediu de solvent nucleofil, solventul concurează eficient cu ionul halogenură în deschiderea inelului cu trei membri al ionului halogeniu:

Formarea produselor de adiție cu participarea unui solvent sau a unui alt agent nucleofil „extern” se numește reacție de adiție conjugată. Când bromul și stirenul reacționează în metanol, se formează doi produși: dibromură vicinală și esterul de brom, al căror raport depinde de concentrația de brom în metanol.
Într-o soluție foarte diluată, domină produsul de adiție conjugat, în timp ce într-o soluție concentrată, dimpotrivă, predomină dibromura vicinală. Într-o soluție apoasă, predomină întotdeauna halohidrina (un alcool care conține un halogen la atomul de carbon) - produsul adiției conjugatului.

ei-conforme transă-2-clorciclohexanolul este stabilizat în continuare printr-o legătură de hidrogen O-H . . . Cl. În cazul alchenelor nesimetrice, în reacțiile de adiție conjugate, halogenul se adaugă întotdeauna la atomul de carbon care conține cel mai mare număr de atomi de hidrogen, iar agentul nucleofil la carbonul cu cel mai mic număr de atomi de hidrogen. Nu se formează un produs izomeric cu un aranjament diferit de grupări de îmbinare. Aceasta înseamnă că ionul ciclic de halogenoniu format ca intermediar trebuie să aibă o structură asimetrică cu două legături C 1 -Hal și C 2 -Hal care diferă ca energie și rezistență și o sarcină pozitivă mare asupra atomului de carbon intern C 2, care poate fi exprimată grafic în două moduri:

Prin urmare, atomul de carbon C2 al ionului de halogeni este supus atacului nucleofil al solventului, în ciuda faptului că este mai substituit și mai puțin accesibil din punct de vedere steric.


Una dintre cele mai bune metode de preparare pentru sinteza bromhidrinelor este hidroxibromurarea alchenelor folosind N-bromosuccinimidă ( N.B.S.) într-un amestec binar de dimetil sulfoxid ( DMSO) și apă.

Această reacție poate fi efectuată în apă sau fără DMSO, cu toate acestea, randamentele de bromhidrine în acest caz sunt oarecum mai mici.



Formarea produșilor de adiție conjugați în reacția de halogenare a alchenelor ne permite, de asemenea, să respingem mecanismul sincron de adăugare a unei molecule de halogen. Adăugarea conjugată la dubla legătură este în acord cu un mecanism în două etape care implică cationul halogeniu ca intermediar.
Pentru reacția de adiție electrofilă la o legătură dublă, ar trebui să ne așteptăm la o creștere a vitezei de reacție în prezența substituenților alchil donatori de electroni și la o scădere a prezenței substituenților care atrage electroni la legătura dublă. Într-adevăr, rata de adăugare a clorului și bromului la dubla legătură crește brusc atunci când se trece de la etilenă la derivații săi substituiți cu metil. De exemplu, rata de adăugare a bromului la tetrametiletilenă este de 10 5 ori mai mare decât rata de adăugare a acestuia la 1-butenă. Această accelerație enormă indică în mod clar polaritatea ridicată a stării de tranziție și gradul ridicat de separare a sarcinii în starea de tranziție și este în concordanță cu mecanismul eletrofil de adiție.
În unele cazuri, adăugarea de clor la alchene care conțin substituenți donatori de electroni este însoțită de extracția unui proton din compusul intermediar în loc de adăugarea unui ion de clorură. Abstracția unui proton are ca rezultat formarea unei alchene substituite cu clor, care poate fi considerată formal ca o substituție directă cu migrarea dublei legături. Cu toate acestea, experimentele cu etichete izotopice indică o natură mai complexă a transformărilor care au loc aici. Când izobutilena este clorurată la 0 0 C, se formează 2-metil-3-cloropropenă (clorura de metalil) în locul diclorurii aşteptate, produsul adiţiei la legătura dublă.

Formal, se pare că există o înlocuire, nu o aderare. Studiul acestei reacții folosind izobutilenă marcată în poziția 1 cu izotopul 14 C a arătat că înlocuirea directă a hidrogenului cu clor nu are loc, deoarece în clorura de metalil rezultată eticheta este situată în grupa 14 CH2Cl. Acest rezultat poate fi explicat prin următoarea secvență de transformări:

În unele cazuri, poate apărea, de asemenea, migrarea 1,2 a grupării alchil

În CCl 4 (solvent nepolar) această reacție dă aproape 100% diclorură B- produs de adiție obișnuită la o legătură dublă (fără rearanjare).
Rearanjamentele scheletice de acest tip sunt cele mai tipice pentru procesele care implică carbocationi deschisi ca particule intermediare. Este posibil ca adăugarea de clor în aceste cazuri să aibă loc nu prin ionul de cloron, ci printr-o particulă cationică apropiată de carbocationul deschis. În același timp, trebuie remarcat faptul că rearanjamentele scheletice sunt un fenomen destul de rar în procesele de adăugare de halogeni și halogeni amestecați la dubla legătură: ele sunt observate mai des în timpul adăugării de clor și mult mai puțin frecvent în timpul adăugării de brom. Probabilitatea unor astfel de rearanjamente crește la trecerea de la solvenți nepolari (CCl 4) la cei polari (nitrometan, acetonitril).
Rezumând datele prezentate privind stereochimia, adiția conjugată, influența substituenților în alchenă, precum și rearanjamentele în reacțiile de adiție a halogenilor la legătura dublă, trebuie remarcat că acestea sunt în bună concordanță cu mecanismul de adiție electrofilă care implică ionul ciclic de halogeniu. Datele privind adăugarea de halogeni amestecați la alchene, pentru care etapele de adăugare sunt determinate de polaritatea legăturii a doi atomi de halogen, pot fi interpretate în același mod.
ALKENES
Hidrocarburile, în molecula cărora, pe lângă legăturile simple carbon-carbon și carbon-hidrogen σ, există legături π carbon-carbon, se numesc nelimitat. Deoarece formarea unei legături π este formal echivalentă cu pierderea a doi atomi de hidrogen de către moleculă, hidrocarburile nesaturate conțin 2p sunt mai putini atomi de hidrogen decat cei limitatori, unde p - numărul de legături π:
Se numește o serie ai cărei membri diferă între ei prin (2H) n serie izologică. Astfel, în schema de mai sus, izologii sunt hexani, hexene, hexadiene, hexine, hexatriene etc.
Hidrocarburile care conțin o legătură π (adică legătură dublă) se numesc alchene (olefine) sau, conform primului membru al seriei - etilena, hidrocarburi de etilenă. Formula lor generală serie omoloagă S p N 2l.
1. Nomenclator
În conformitate cu regulile IUPAC, la denumirea alchenelor, cel mai lung lanț de carbon care conține o legătură dublă primește numele alcanului corespunzător în care terminația -unînlocuit cu -ro. Acest lanț este numerotat în așa fel încât atomii de carbon implicați în formarea dublei legături să primească cele mai mici numere posibile:

Radicalii sunt denumiți și numerotați ca în cazul alcanilor.
Pentru alchenele cu structură relativ simplă sunt permise denumiri mai simple. Astfel, unele dintre cele mai frecvente alchene sunt denumite prin adăugarea sufixului -ro la numele unui radical de hidrocarbură cu același schelet de carbon:
Radicalii de hidrocarburi formați din alchene primesc sufixul -enil. Numerotarea în radical pleacă de la atomul de carbon având valență liberă.

Cu toate acestea, pentru cei mai simpli radicali alchenil, în loc de denumiri sistematice, este permisă utilizarea celor banale: Atomii de hidrogen legați direct de atomi de carbon nesaturați formând o legătură dublă sunt adesea numiți
atomi de hidrogen de vinil,
2. Izomerie Pe lângă izomeria scheletului de carbon, în seria alchenelor apare și izomeria poziției dublei legături. În general, acest tip de izomerie este izomeria poziției substituentului (funcției)
- observat în toate cazurile când molecula conține orice grupare funcțională. Pentru alcanul C4H10, sunt posibili doi izomeri structurali:

Pentru alchena C4H8 (butenă), sunt posibili trei izomeri:
Buten-1 și buten-2 sunt izomeri ai poziției funcției (în acest caz, rolul său este jucat de o legătură dublă). Izomerii spațiali diferă în aranjarea spațială a substituenților unul față de celălalt și sunt numiți izomeri cis, dacă substituenții sunt localizați pe aceeași parte a dublei legături și izomeri trans,

dacă pe părți opuse:
3. Structura unei duble legături Energia de scindare a unei molecule la dubla legătură C=C este de 611 kJ/mol; întrucât energia legăturii C-C σ este de 339 kJ/mol, energia de rupere a legăturii π este de numai 611-339 = 272 kJ/mol. Electronii π sunt mult mai ușori decât electronii σ și sunt sensibili la influența, de exemplu, a solvenților polarizați sau a oricăror reactivi atacatori., egal cu 0,134 nm, adică semnificativ mai mică decât distanța dintre atomii de carbon legați printr-o singură legătură (0,154 nm). Pe măsură ce „jumătățile” moleculei se rotesc unele față de altele de-a lungul axei dublei legături, gradul de suprapunere orbitală scade, ceea ce este asociat cu consumul de energie. Consecința acestui lucru este absența rotației libere de-a lungul axei dublei legături și existența izomerilor geometrici cu substituție corespunzătoare la atomii de carbon.
La fel ca alcanii, omologii inferiori ai unui număr dintre cele mai simple alchene sunt gaze în condiții normale și, începând de la C5, sunt lichide cu punct de fierbere scăzut.

Toate alchenele, ca și alcanii, sunt practic insolubile în apă și foarte solubile în alți solvenți organici, cu excepția alcoolului metilic; toate au o densitate mai mică decât apa.
5. Proprietăți chimice
Când se ia în considerare reactivitatea compușilor organici complecși, se aplică următoarele: principiu general. În majoritatea reacțiilor, nu radicalul de hidrocarbură „inert” este cel care participă, ci grupările funcționale existente și mediul lor imediat. Acest lucru este firesc, deoarece majoritatea conexiunilor sunt mai puțin puternice decât Conexiuni S-Sși C-H și, în plus, legăturile din și lângă grupa funcțională sunt cele mai polarizate.
Este firesc să ne așteptăm ca reacțiile alchenelor să aibă loc printr-o legătură dublă, care poate fi considerată și o grupare funcțională și, prin urmare, vor fi reacții de adiție, și nu reacții de substituție caracteristice alcanilor considerați anterior.
Adaos de hidrogen
Adăugarea de hidrogen la alchene duce la formarea de alcani:
Adăugarea de hidrogen la compușii de etilenă în absența catalizatorilor are loc numai la temperaturi ridicate, la care începe adesea descompunerea substanțelor organice. Adăugarea de hidrogen are loc mult mai ușor în prezența catalizatorilor.
Catalizatorii sunt metale din grupa platinei în stare fin dispersată, platina însăși și în special paladiu - deja la temperaturi obișnuite. Descoperirea lui Sabatier, care a folosit nichel zdrobit fin special preparat la o temperatură de 150-300°C și în numeroase lucrări a demonstrat versatilitatea acestui catalizator pentru o serie de reacții de reducere, a avut o importanță practică deosebită.
Adăugarea de halogeni

În prima etapă a acestei reacții, interacțiunea are loc între electronii π ai dublei legături și speciile de halogen electrofile pentru a forma complexul π (I).

Apoi, complexul π este rearanjat în ionul de oniu (bromoniu) (II) cu eliminarea anionului halogen, care este în echilibru cu carbocationul (III).

Anionul atacă apoi ionul de oniu pentru a forma produsul de adiție (IV):

Atacul anionic al ionului de bromoniu (II) pentru a forma dibromură (IV) are loc în poziția trans. Astfel, în cazul adăugării de Br2 la ciclopentenă, se formează numai trans-1,2-dibromodiclo-pentan:
Dovada adăugării în două etape de halogen la alchene este faptul că, atunci când Br 2 este adăugat la ciclohexenă în prezența NaCI, nu numai trans-1,2-dibromociclohexan, ci și trans-1-bromo-2-clorociclohexan este format:
Halogenare radicală
În condiții dure (fază gazoasă, 500°C), halogenii nu se adaugă la dubla legătură, dar are loc halogenarea poziției α:
În acest caz, reacția urmează un mecanism radical.
Adăugarea de halogenuri de hidrogen

Halogenurile de hidrogen se adaugă la alchene pentru a forma halogenuri de alchil. În cazul moleculelor asimetrice, adăugarea urmează regula lui Markovnikov, adică hidrogenul se atașează de atomul de carbon cel mai hidrogenat (cu cel mai mare număr de atomi de hidrogen): Această reacție, ca și adăugarea de brom la etilenă, are loc după formarea complexului π prin etapa de formare a ionului de protoniu:
În prezența peroxizilor, bromura de hidrogen nu se adaugă conform regulii lui Markovnikov
(efectul Kharash):

În prezența peroxizilor, reacția nu are loc prin mecanismul de adăugare electrofilă, ca mai sus, ci printr-un mecanism radical. Prima etapă este atacul radicalului peroxid asupra moleculei de HBr:
Radicalul brom rezultat se adaugă la propilenă pentru a forma un nou radical:
Acesta din urmă este stabilizat datorită expulzării hidrogenului dintr-o nouă moleculă de HBr cu regenerarea unui nou radical de brom etc.:
Și în acest caz, direcția procesului este determinată de stabilitatea radicalilor brompropan: predominant se formează cel mai stabil, conducând la 1-brompropan.
Adăugarea de apă și acid sulfuric
În prezența acizilor, apa se adaugă la dubla legătură conform regulii lui Markovnikov: Aceeași reacție are loc cu acidul sulfuric:
În prima etapă, conform mecanismului de adiție cis, ionul MnO 4 este adăugat la legătura multiplă, urmat de scindarea hidrolitică a produsului de adiție instabil și eliberarea ionului MnO 3 -.

Reacția urmează schema de adiție cis:

Soluțiile acide de permanganat oxidează alchenele cu scindarea lanțului la legătura C=C și formarea de acizi sau cetone:
Efectul ozonului asupra alchenelor
Această reacție duce la ozonide cristaline, foarte explozive, care la hidroliză formează aldehide sau cetone:

Reacția este adesea folosită pentru a determina poziția dublei legături într-o moleculă, deoarece structura alchenei originale poate fi imaginată din compușii carbonilici formați.
Reacția se desfășoară prin cis-cicloadiție prin stadiul de molozonide instabilă, care suferă disociere și recombinare ulterioară:

Polimerizarea alchenelor
De o importanță deosebită este polimerizarea etilenei și propilenei în polimeri cu o greutate moleculară de aproximativ 105. Până în 1953, polimerizarea radicalică (inițiată de radicali liberi) a fost utilizată în principal, deși în principiu s-a folosit atât inițierea anionică, cât și cationică a procesului.
După munca lui Ziegler și Nutt, care au primit Premiul Nobel pentru aceste studii, așa-numitul polimerizare prin coordonare. Cel mai simplu catalizator „Ziegler” de acest tip constă din compuși de trietilaluminiu și titan (IV). În acest caz, polimerii sunt formați cu grad înalt stereoregularitate. De exemplu, la polimerizarea propilenei, se formează polipropilenă izotactică - un polimer în care toate grupările CH3 laterale ocupă aceeași poziție spațială:

Acest lucru conferă polimerului o rezistență mai mare și poate fi chiar folosit pentru a face fibre sintetice.
Polietilena obținută prin această metodă este o hidrocarbură saturată cu catenă liniară. Este mai puțin elastic decât polietilena de înaltă presiune, dar are o duritate mai mare și poate rezista la temperaturi mai ridicate.
Datorită combinației de multe proprietăți valoroase, polietilena are o gamă foarte largă de aplicații. Este unul dintre cele mai bune materiale pentru izolarea cablurilor, pentru utilizare în tehnologia radar, inginerie radio, agricultură etc. Din el sunt realizate țevi, furtunuri, vase, recipiente pentru produse agricole și îngrășăminte, folii de diferite grosimi și multe articole de uz casnic. Foliile durabile din polietilenă au început chiar să fie folosite ca acoperire pentru fundul canalelor artificiale pentru a le face impermeabile.
Telomerizarea
Un proces interesant utilizat industrial este copolimerizarea etilenei cu tetraclorură de carbon, numită telomerizare. Dacă la un amestec de etilenă și CC14 se adaugă peroxid de benzoil sau un alt inițiator care se descompune pentru a forma radicali liberi, are loc următorul proces:
Radicalii CC1 3" inițiază polimerizarea în lanț a etilenei:
Când întâlnește o altă moleculă CC1 4, creșterea lanțului se oprește:
Radical CC1 3 - dă naștere unui nou lanț.
Produșii de polimerizare cu greutate moleculară mică care rezultă care conțin atomi de halogen la capetele lanțului se numesc telomerii. Telomeri cu valorile obținute n =2,3, 4, ...,15.
Hidroliza produselor de telomerizare produce acizi carboxilici ω-cloro-substituiți, care sunt produse chimice valoroase.
Formula generală a alchenelor: CnH2n(n 2)
Primii reprezentanți ai seriei omoloage de alchene:

Formulele alchenelor pot fi compilate din formulele corespunzătoare ale alcanilor (hidrocarburi saturate). Denumirile alchenelor se formează prin înlocuirea sufixului -ane al alcanului corespunzător cu -enă sau –ilenă: butan - butilenă, pentan - pentenă etc.
Numărul atomului de carbon cu o legătură dublă este indicat printr-o cifră arabă după nume.

Atomii de carbon implicați în formarea dublei legături se află într-o stare de hibridizare sp. Trei legături formate din orbitali hibrizi și sunt situate în același plan la un unghi de 120° unul față de celălalt. O legătură suplimentară este formată prin suprapunerea laterală a orbitalilor p nehibrizi:
Lungimea legăturii duble C=C (0,133 nm) este mai scurtă decât lungimea legăturii simple (0,154 nm). Energia unei legături duble este mai mică decât de două ori energia unei legături simple, deoarece energia legăturii - este mai mică decât energia legăturii -.
Izomeri alchenei
Izomerul interclas al propenei (C3H6) este ciclopropanul. Începând cu butenă (C 4 H 8), izomeria apare prin poziția dublei legături (butenă-1 și butenă-2), izomeria scheletului de carbon (metilpropenă sau izobutilenă), precum și izomeria spațială (cis-butenă-). 2 și trans-butenă-2). În izomerii cis, substituenții sunt localizați pe o parte, iar în izomerii trans, ei sunt localizați pe părți opuse ale dublei legături.
Proprietățile chimice și activitatea chimică a alchenelor sunt determinate de prezența unei duble legături în moleculele lor. Cele mai tipice reacții pentru alchene sunt adiția electrofilă: hidrohalogenare, hidratare, halogenare, hidrogenare, polimerizare.
Reacție calitativă la o legătură dublă – decolorarea apei cu brom:
Exemple de rezolvare a problemelor pe tema „formula alchenelor”
EXEMPLUL 1
| Exercita | Câți izomeri capabili să decoloreze apa cu brom are o substanță cu compoziția C 3 H 5 Cl? Scrie formule structurale aceşti izomeri |
| Soluţie | C3H5CI este un derivat monoclor al hidrocarburii C3H6. Această formulă corespunde fie propenei, unei hidrocarburi cu o dublă legătură, fie ciclopropanului (o hidrocarbură ciclică). Această substanță decolorează apa de brom, ceea ce înseamnă că conține o legătură dublă. Trei atomi de carbon pot forma doar această structură: întrucât izomeria scheletului de carbon și poziția dublei legături este imposibilă cu un asemenea număr de atomi de carbon. Izomeria structurală într-o moleculă dată este posibilă numai datorită unei modificări a poziției atomului de clor față de legătura dublă: Pentru 1-cloropropenă, este posibilă izomeria cis-trans: |
| Răspuns | Condițiile problemei sunt îndeplinite de 4 izomeri |
EXEMPLUL 2
| Exercita | Un amestec de hidrocarburi izomerice (gaze cu o densitate a hidrogenului de 21) cu un volum de 11,2 litri (n.s.) a reactionat cu apa cu brom. Rezultatul a fost 40,4 g de derivat dibrom corespunzător. Ce structură au aceste hidrocarburi? Determinați conținutul lor volumetric în amestec (în%). |
| Soluţie | Formula generală a hidrocarburilor este C x H y. Să calculăm masa molara hidrocarburi: Prin urmare, formula hidrocarburilor este C 3 H 6. Doar două substanțe au această formulă - propenă și ciclopropan. Doar propena reacţionează cu apa cu brom: Să calculăm cantitatea de substanță derivată dibrom: Conform ecuației reacției: n(propenă) mol Cantitatea totală de hidrocarburi din amestec este egală cu: |